Cancro do pâncreas: diferenças entre revisões
| Linha 114: | Linha 114: | ||
Embora a cirurgia com finalidade curativa já não esteja associada às elevadas taxas de mortalidade que ocorriam até à década de 1980, uma proporção significativa dos doentes (30–45%) continua a necessitar de tratamento para doenças pós-operatórias que não são provocadas pelo cancro em si. A complicação mais comum da cirurgia é a dificuldade em esvaziar o estômago.<ref name="Wolfgang2013"/> Podem ainda ser utilizados alguns procedimentos cirúrgicos para aliviar determinados sintomas. Por exemplo, se o cancro estiver a invadir ou comprimir o duodeno ou o [[intestino grosso]], um ''bypass'' pode reverter a obstrução e melhorar significativamente a qualidade de vida, embora a intervenção não se destine à cura.<ref name="Bond-Smith" /> |
Embora a cirurgia com finalidade curativa já não esteja associada às elevadas taxas de mortalidade que ocorriam até à década de 1980, uma proporção significativa dos doentes (30–45%) continua a necessitar de tratamento para doenças pós-operatórias que não são provocadas pelo cancro em si. A complicação mais comum da cirurgia é a dificuldade em esvaziar o estômago.<ref name="Wolfgang2013"/> Podem ainda ser utilizados alguns procedimentos cirúrgicos para aliviar determinados sintomas. Por exemplo, se o cancro estiver a invadir ou comprimir o duodeno ou o [[intestino grosso]], um ''bypass'' pode reverter a obstrução e melhorar significativamente a qualidade de vida, embora a intervenção não se destine à cura.<ref name="Bond-Smith" /> |
||
====Quimioterapia==== |
|||
| ⚫ | |||
A [[quimioterapia]] e a [[radioterapia]] podem ser úteis associadas à cirurgia ou somente como tratamento paliativo. |
|||
Após a cirurgia e um período de recobro de um ou dois meses, pode ser oferecida à pessoa a possibilidade de quimioterapia [[Terapia adjuvante|adjuvante]] com [[gencitabina]] ou [[Fluorouracila|5-FU]], desde que esteja apta fisicamente.<ref name="Lancet"/><ref name=ESMOPA /> Em pessoas que não estejam aptas a receber cirurgia curativa, a quimioterapia pode ser usada para melhorar a [[qualidade de vida]].<ref name="Wolfgang2013"/> Em casos considerados limitrofes em relação à possibilidade de remoção, é possível recorrer a quimioterapia [[Terapia neoadjuvante|neoadjuvante]] ou quimioradioterapia de modo a reduzir o cancro até a um nível em que se possa proceder à cirurgia. Nos restantes casos, a terapia neoadjuvante permanece controversa, uma vez que atrasa a cirurgia.<ref name="Wolfgang2013"/><ref name="Lancet"/><ref>{{citar periódico | autor = Heinemann V, Haas M, Boeck S | título = Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer. | jornal = Annals of oncology : official journal of the European Society for Medical Oncology / ESMO | volume = 24 | número = 10 | páginas = 2484–92 | data = Outubro de 2013 | pmid = 23852311 }}</ref> |
|||
A [[gencitabina]] foi aprovada nos Estados Unidos em 1997, após um [[ensaio clínico]] ter verificado a melhorias na qualidade de vida e um prolongamento de cinco semanas na duração média de sobrevivência em pessoas com cancro pancreático avançado.<ref name=thota>{{citar periódico | autor = Thota R, Pauff JM, Berlin JD | título = Treatment of metastatic pancreatic adenocarcinoma: a review | jornal = Oncology (Williston Park, N.Y.) | volume = 28 | número = 1 | páginas = 70–4 | data = Janeiro de 2014 | pmid = 24683721 }}</ref> A quimioterapia unicamente com gencitabina foi a norma durante uma década, uma vez que as combinações com outros fármacos não demonstraram resultados significativamente melhores. No entanto, verificou-se que a combinação de gencitabina com [[erlotinibe]] aumentava ligeiramente a sobrevivência, tendo esta última sido licenciada para uso em cancro do pâncreas nos Estados Unidos em 2005.<ref name="FDA2005">{{citar web |url=http://www.cancer.gov/cancertopics/druginfo/fda-erlotinib-hydrochloride#Anchor-Pancreati-44285 |website= National Cancer Institute |editora= National Institutes of Health |título=Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride |data= 3 de julho de 2013 |acessodata= 5 de dezembro de 2014}}</ref> |
|||
Verificou-se também que o [[protocolo para tratamento da quimioterapia]] [[FOLFIRINOX]], que é uma combinação de quatro fármacos, é mais eficaz que a gencitabina. No entanto, possui também efeitos secundários significativos, pelo que só é adequado a pessoas devidamente aptas. Este é também o caso do [[paclitaxel ligado a proteína]] (nab-paclitaxel), licenciado pela primeira vez em 2013 para o uso com gencitabina em cancros do pâncreas.<ref name="Borazanci2014">{{citar periódico | autor = Borazanci E, Von Hoff DD | título = Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer | jornal = Expert Rev Gastroenterol Hepatol | volume = 8 | número = 7 | páginas = 739–47 | data = Setembro de 2014 | pmid = 24882381 | doi = 10.1586/17474124.2014.925799 | last2 = Von Hoff | first2 = DD }}</ref> Por volta do final de 2013, tanto o FOLFIRINOX como o nab-paclitaxel com gencitabina eram vistos como boas escolhas para pessoas capazes de tolerar os efeitos secundários, enquanto a gencitabina isolada continuava a ser uma opção eficaz para pessoas que não o eram. Está por realizar um ensaio que compare diretamente as duas opções, continuando a ser investigadas outras possíveis combinações. No entanto, as inovações introduzidas nos últimos anos apenas prolongaram o tempo médio de sobrevivência por alguns meses.<ref name=thota /><ref name="Lancet"/> |
|||
| ⚫ | |||
A radioterapia pode ser usada como parte do tratamento com o intuito de reduzir o tumor até uma dimensão operável, embora o seu uso em tumores inoperáveis permaneça controverso, uma vez que os resultados dos ensaios são contraditórios.<ref name="NEJM14" /> Desde a década de 1980 que o uso de [[radioterapia]] enquanto tratamento adjuvante após cirurgia potencialmente curativo tem sido também controverso.<ref name="Wolfgang2013"/> A [[Sociedade Europeia de Oncologia Médica]] recomenda que a radioterapia adjuvante seja usada apenas em pessoas inscritas em ensaios clínicos.<ref name=ESMOPA /> No entanto, há uma crescente tendência entre médicos nos Estados Unidos para o uso de radioterapia. Desde a década de 1980 que vários ensaios clínicos têm testado diversas combinações de tratamentos, mas não existem ainda conclusões definitivas.<ref name="Wolfgang2013"/><ref name="Lancet" /> |
|||
===PanNETs=== |
|||
{{AP|Tumor neuroendócrino<!--|tumor neuroendócrino pancreático-->}} |
|||
O tratamento de tumores neuroendócrinos pancreáticos (PanNET), incluindo os tipos [[Malignidade|malignos]] menos comuns, pode ser realizado através de diversas abordagens.<ref name="NCCN_NET201501">{{citar web|título=Neuroendocrine tumors, NCCN Guidelines Version 1.2015|website=NCCN Guidelines|editora=National Comprehensive Cancer Network, Inc. |url=http://www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf|acessodata=25 de dezembro de 2014|data=11 de novembro de 2014}}</ref><ref name="Falconi2012">{{citar periódico | autor = Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, Salazar R, Taal BG, Vullierme MP, O'Toole D | título = ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors | jornal = Neuroendocrinology | volume = 95 | número = 2 | páginas = 120–34 | ano = 2012 | pmid = 22261872 | doi = 10.1159/000335587 }}</ref><ref name="Jensen2012">{{citar periódico | autor = Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R | título = ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes | jornal = Neuroendocrinology | volume = 95 | número = 2 | páginas = 98–119 | ano = 2012 | pmid = 22261919 | pmc = 3701449 | doi = 10.1159/000335591 }}</ref><ref name="Pavel2012">{{citar periódico | autor = Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R | título = ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary | jornal = Neuroendocrinology | volume = 95 | número = 2 | páginas = 157–76 | ano = 2012 | pmid = 22262022 | doi = 10.1159/000335597 }}</ref> Alguns tumores de pequena dimensão (< 1 cm) que sejam identificados acidentalmente (por exemplo, durante uma TAC), podem continuar a ser vigiados até haver eventuais alterações significativas.<ref name="NCCN_NET201501" /> Isto depende da avaliação do risco de cirurgia, o qual é inflenciado pela lozalização do tumor e da [[Comorbidade|presença de outros problemas médicos]].<ref name="NCCN_NET201501" /> Os tumores que estejam situados apenas no pâncreas (tumores localizados) ou com poucas metástases (por exemplo, apenas no fígado), podem ser removidos cirurgicamente. O tipo de cirurgia depende da localização do tumor e do grau de afetação dos gânglios linfáticos.<ref name=pmid22997445/> |
|||
No caso de tumores localizados, os procedimentos cirúrgicos podem ser muito menos intrusivos do que os tipos de cirurgia usados no tratamento de adenocarcinomas pancreáticos descritos acima. O prognóstico varia imenso; alguns tipos têm uma taxa de sobrevivência bastante elevada após a cirurgia, enquanto para outros o prognóstico é reservado. Uma vez que este grupo de tumores é raro, as recomendações salientam que o tratamento deve ser realizado num centro hospitalar especializado.<ref name="Burns2012"/><ref name=pmid22997445 /> Em determinados casos onde existem metástases no fígado, pode ser considerado um transplante hepático.<ref name="Rossi2014">{{citar periódico | autor = Rossi RE, Massironi S, Conte D, Peracchi M | título = Therapy for metastatic pancreatic neuroendocrine tumors | jornal = Annals of Translational Medicine | volume = 2 | número = 1 | página = 8 | ano = 2014 | pmid = 25332984 | doi = 10.3978/j.issn.2305-5839.2013.03.01 }}</ref> |
|||
Em casos de tumores funcionais, a classe de medicamentos análogos da [[somatostatina]], como a [[octreotida]], pode reduzir a produção excessiva de hormonas.<ref name=pmid22997445/> O [[lanreotide]] pode atrasar o crescimento do tumor.<ref>{{citar web|título=FDA Approves Lanreotide for Neuroendocrine Tumors|url=http://www.medscape.com/viewarticle/836729|autor=Nick Mulcahy |website=Medscape Medical News |editora=WebMD LLC|acessodata=25 d edezembro de 2014|data=17 de dezembro de 2014}}</ref> Se o tumor não permite remoção cirúrgica e provoca sintomas, esses sintomas podem ser diminuídos através de terapia orientada com [[everolimo]] ou [[sunitinib]], atrasando o avanço da doença.<ref name="Burns2012"/><ref name="ASCOPost20110515Evero">{{Citar periódico |título=Everolimus Approved for Pancreatic Neuroendocrine Tumors. |jornal=The ASCO Post. |data=15 de maio de 2011 |volume=2 |número=8 |url=http://ascopost.com/articles/may-15-2011/everolimus-approved-for-pancreatic-neuroendocrine-tumors/}}</ref><ref>{{Citar web |autor=National Cancer Institute. Cancer Drug Information. |título=FDA Approval for Sunitinib Malate. Pancreatic Neuroendocrine Tumors |url=http://www.cancer.gov/cancertopics/druginfo/fda-sunitinib-malate}}</ref> A quimioterapia [[Citotoxicidade|citotóxica]] padrão é geralmente pouco eficaz no caso dos PanNET, mas pode ser usada quando os outros tratamentos não impedem a progressão da doença,<ref name="Burns2012"/><ref name="Tejani2014">{{citar periódico | autor = Tejani MA, Saif MW | título = Pancreatic neuroendocrine tumors: Does chemotherapy work? | jornal = JOP: Journal of the pancreas | volume = 15 | número = 2 | páginas = 132–4 | ano = 2014 | pmid = 24618436 | doi = 10.6092/1590-8577/2301 }}</ref> ou em cancros PanNET pouco diferenciados.<ref name="Benson2010">{{citar web| autor=Benson AB, Myerson RJ, Sasson AR. | título =Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010. |isbn=978-0-615-41824-7 |url=http://www.cancernetwork.com/cancer-management/pancreatic/article/10165/1802606}}</ref> |
|||
A radioterapia é ocasionalmente usada quando se verifica dor por extensão anatómica, como no caso de metástases nos ossos. Alguns PanNET absorvem hormonas ou [[peptídeo]]s específicos, podendo responder à terapia de [[medicina nuclear]] com peptídeos ou hormonas com [[radiomarcação]], como o [[iobenguano]].<ref name="Gulenchyn">{{citar periódico | autor = Gulenchyn KY, Yao X, Asa SL, Singh S, Law C | título = Radionuclide therapy in neuroendocrine tumours: A systematic review | jornal = Clinical Oncology | volume = 24 | número = 4 | páginas = 294–308 | ano = 2012 | pmid = 22221516 | doi = 10.1016/j.clon.2011.12.003 }}</ref><ref name="Vinik">{{citar periódico | autor = Vinik AI | título = Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS) | jornal = Endocrine Practice | volume = 20 | número = 11 | páginas = 1–23 | ano = 2014 | pmid = 25297671 | doi = 10.4158/EP14373.RA }}</ref><ref name="Kwekkeboom">{{citar periódico | autor = Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP | título = Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors | jornal = Seminars in Nuclear Medicine | volume = 40 | número = 2 | páginas = 78–88 | ano = 2010 | pmid = 20113677 | doi = 10.1053/j.semnuclmed.2009.10.004 }}</ref><ref name="Bodei ">{{citar periódico | autor = Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G | título = Peptide receptor radionuclide therapy for advanced neuroendocrine tumors | jornal = Thoracic Surgery Clinics | volume = 24 | número = 3 | páginas = 333–49 | ano = 2014 | pmid = 25065935 | doi = 10.1016/j.thorsurg.2014.04.005 }}</ref> Podem também ser utilizadas [[ablação por radiofrequência]], [[crioablação]] e [[embolização da artéria hepática]].<ref name="Castellano">{{citar periódico | autor = Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E | título = Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors | jornal = Cancer Chemotherapy and Pharmacology | ano = 2014 | pmid = 25480314 | doi = 10.1007/s00280-014-2642-2 }}</ref><ref name="Singh2014">{{citar periódico | autor = Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C | título = Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group | jornal = Annals of Surgical Oncology | ano = 2014 | pmid = 25366583 | doi = 10.1245/s10434-014-4145-0 }}</ref> |
|||
===Cuidados paliativos=== |
|||
[[Cuidados paliativos]] é a prestação de cuidados de saúde focada no tratamento de sintomas de doenças graves, como o cancro, e na melhoria da qualidade de vida.<ref>{{citar web|título=Palliative or Supportive Care|url=http://www.cancer.org/treatment/treatmentsandsideeffects/palliativecare/index|editora=American Cancer Society|data= 2014 |acessodata=20 de agosto de 2014}}</ref> Uma vez que o adenocarcinoma pancreático geralmente só é diagnosticado quando já se encontra numa fase avançada, os cuidados paliativos são muitas vezes o único tratamento possível.<ref>{{citar periódico | autor = Buanes TA | título = Pancreatic cancer-improved care achievable | jornal = World journal of gastroenterology : WJG | volume = 20 | número = 30 | páginas = 10405–18 | data = 14 de agosto de 2014 | pmid = 25132756 | doi = 10.3748/wjg.v20.i30.10405 }}</ref> Os cuidados paliativos focam-se no tratamento de sintomas como a dor ou náuseas, e podem auxiliar a tomade de decisões, incluindo quando ou se é necessário o internamento numa unidade dedicada.<ref>{{citar web|título=If treatment for pancreatic cancer stops working|url=http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-after-no-longer-working|editora=American Cancer Society|data= 11 de junho de 2014 |acessodata=20 de agosto de 2014}}</ref> |
|||
A dor pode ser tratada com medicamentos como os [[opiáceo]]s ou através de intervenções cirúrgicas, como o bloqueio de nervos no [[plexo solar]]. Este procedimento altera ou, dependendo da técnica, destrói os nervos que transmitem dor a partir do abdómen, constituindo uma forma segura e eficaz de reduzir a dor, reduzindo também a necessidade de analgésicos ou opiáceos, os quais têm efeitos adversos significativos.<ref name="Wolfgang2013"/><ref>{{citar periódico | autor = Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA | título = Celiac plexus block for pancreatic cancer pain in adults | jornal = Cochrane Database Syst Rev | volume = | número = 3 | página = CD007519 | ano = 2011 | pmid = 21412903 | doi = 10.1002/14651858.CD007519.pub2 | editor=Arcidiacono, Paolo G }}</ref> |
|||
Outros sintomas ou complicações que podem ser tratados com cirurgia paliativa são obstruções por parte do tumor dos intestinos ou dos [[Ducto biliar|ductos biliares]]. Neste último caso, que ocorre em mais de metade dos casos de cancro pancreático, é inserido por via endoscópica um ''[[stent]]'' metálico que mantém a drenagem dos ductos.<ref name="Cruz" /> Os cuidados paliativos também podem ajudar a tratar a [[depressão nervosa|depressão]] associada ao diagnóstico de cancro do pâncreas.<ref name="Wolfgang2013"/> |
|||
Tanto a cirurgia como os tumores inoperáveis levam muitas vezes a distúrbios no [[aparelho digestivo]], causadas pela ausência de produtos exócrinos no pâncreas (insuficiência exócrina). Estes distúrbios podem ser tratados com [[pancreatina]], um medicamento que contém enzimas pancreáticas sintéticas.<ref name="Bond-Smith" /> A dificuldade em esvaziar o estômago é comum é pode ser um problema grave que necessita de hospitalização. O tratamento pode envolver uma série de abordagens, incluindo a drenagem do estômago por [[Sonda nasogástrica|aspiração nasogástrica]] e por fármacos denominados [[Inibidor da bomba de protões|inibidores da bomba de protões]] ou [[Anti-histamínico H2|antagonistas do receptor H2]], os quais reduzem a produção de [[ácido gástrico]].<ref name="Bond-Smith" /> |
|||
==Prognóstico== |
|||
O adenocarcinoma pancreático e os menos comuns cancros exócrinos apresentam um [[prognóstico]] bastante reservado, uma vez que geralmente só são diagnosticados em fases avançadas e quando o cancro já tem uma dimensão considerável ou se propagou para outras partes do corpo.<ref name="NEJM14" /> No caso dos PanNET, o prognóstico é superior, uma vez que muitos são benignos e não apresentam quaisquer sintomas clínicos, e mesmo os casos incuráveis apresnetam uma taxa de sobrevivência aos cinco anos superior a 16%.<ref name="cancer.org"/> No entanto, o prognóstico varia consideravelmente em função do tipo.<ref name="Sol PanNET" >{{citar web | editora= Johns Hopkins Medicine |website= The Sol Goldman Pancreas Cancer Research Center |url= http://pathology.jhu.edu/pancreas/TreatmentEndocrine.php?area=tr#PROGNOSIS |título= Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas |data= 2012 |acessodata= 5 de janeiro de 2015}}</ref> |
|||
No caso dos denocarcinomas pancreáticos já avançados ou com metástases, que juntos representam 80% dos casos, os diversos ensaios recentes que compararam os regimes de quimioterapia demonstraram uma melhoria no tempo média de osbrevivência, embora não seja superior a um ano.<ref name="NEJM14" /><ref name="thota" /> Por exemplo, nos Estadus Unidos, a taxa de sobrevivência ao quinto ano era de 2% entre 1975 e 1977, melhorando para 4% entre 1987 e 1989 e para 6% entre 2003 e 2009.<ref>{{citar web|título=Cancer Facts and Figures 2014|url=http://www.cancer.org/acs/groups/content/@research/documents/webcontent/acspc-042151.pdf|website=American Cancer Society|acessodata=5 de janeiro de 2015}}</ref> Nos restantes 20% de casos de adenocarcinoma pancreático com diagnóstico localizado e de pequeno crescimento (<2 cm e estágio T1), cerca de 20% dos norte-americanos sobrevive para além dos cinco anos.<ref name="PDQ2014P"/> |
|||
== História == |
== História == |
||
Revisão das 18h09min de 9 de fevereiro de 2015
| Câncer pancreático | |
|---|---|
| Especialidade | oncologia, gastrenterologia |
| Classificação e recursos externos | |
| CID-10 | C25 |
| CID-9 | 157 |
| CID-11 | 542147910 |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |
| eMedicine | med/1712 |
| MeSH | D010190 |
O cancro pancreático (português europeu) ou câncer pancreático (português brasileiro) surge quando as células do pâncreas, um órgão glandular atrás do estômago, se começam a multiplicar de forma descontrolada e formam um tumor. Estas células cancerígenas têm a capacidade de invadir outras partes do corpo.[1] Existem diversos tipos de cancro do pâncreas. O mais comum, adenocarcinoma pancreático, corresponde a aproximadamente 85% dos casos e em muitas situações o termo "cancro do pâncreas" é usado para designar apenas este tipo. Estes adenocarcinomas começam-se a formar na parte do pâncreas que produz as enzimas digestivas. A partir destas células podem também sugir vários outros tipos de cancro, que no conjunto representam a maioria dos não-adenocarcinomas. Um a dois em cada mil casos de cancro do pâncreas são tumores neuroendócronos, que se formam a partir das células produtoras de hormonas no pâncreas. Este tipo é geralmente menos agressivo que o adenocarcinoma pancreático. Entre os sintomas mais comuns de cancro pancreático estão a coloração amarelada da pele, dores abdominais e nas costas, perda de peso inexplicável, fezes de coloração clara, urina escura e perda de apetite. Geralmente os sintomas não se manifestam durante as primeiras fases da doença, enquanto que os sintomas que são suficientemente específicos para suspeitar de canco pancreático só se manifestam quando a doença se encontra num estágio avançado.[2] Em muitos casos, no momento do diagnóstico o canco já se disseminou para outras partes do corpo.[3][4]
O cancro do pâncreas raramente ocorre antes dos 40 anos de idade e mais de metade dos casos de adenicarcinoma pancreático ocorrem em pessoas com mais de 70.[2] Entre os fatores de risco para a doença estão o tabagismo, obesidade, diabetes e determinadas condições genéticas raras.[2] Mais de um quarto dos casos estão relacionados com o fumo do tabaco,[5] e 5–10% estão associados a genes herdados.[2] O cancro pancreático é geralmente diagnosticado com recurso a um conjunto de técnicas de imagiologia médica, como ecografia ou tomografia computadorizada, análises ao sangue e biópsia de amostras de tecido.[5][6] A doença divide-se em estágios, desde o estágio I até ao estágio IV.[3] Não há evidências de que o rastreio da população em geral seja eficaz.[7]
O risco de desenvolver cancro do pâncreas é menor entre não fumadores e pessoas que mantêm um peso saudável e limitam o consumo de carne vermelha ou processada.[8] A probabilidade de um fumador desenvolver a doença diminui caso cesse de fumar, regressando aos valor da população em geral ao fim de 20 anos.[4] O cancro do pâncreas pode ser tratado com cirurgia, radioterapia, quimioterapia, cuidados paliativos ou a cojugação de vários. As opções de tratamento dependem em parte do estágio do cancro. A cirurgia é o único tratamento que cura a doença, embora também possa ser realizada com o objetivo de melhorar a qualidade de vida da pessoa, mesmo sem possibilidade de cura.[9] Por vezes é necessária medicação e medidas para gestão da dor.[3] Os cuidados paliativos são recomendados até para pessoas cujo tratamento se destine à cura.[10][11]
Em 2012, os cancros pancreáticos de todos os tipos foram a sétima causa mais comum de mortes por cancro, correspondente a 330 000 mortes anuais à escala global.[4] Nos Estados Unidos, o cancro do pâncreas é a quarta causa mais comum de morte por cancro.[12][13] A ocorrência da doença é maior em países desenvolvidos, nos quais tiveram origem 70% dos novos casos em 2012.[4] O adenocarcinoma pancreático apresenta geralmente um prognóstico muito reservado: após o diagnóstico, apenas 25% das pessoas sobrevive mais de um ano e apenas 5% sobrevive por mais de cinco anos.[4][14] Nos casos em que o cancro é diagnosticado durante a fase inicial, a taxa de sobrevivência após cinco anos aumente para aproximadamente 20%.[15] Os cancos neuroendócrinos apresentam um diagnóstico mais positivo; após cinco anos, a taxa de sobrevivência é de 65%, embora dependa consideravelmente do tipo de tumor.[4]
Classificação

Os diversos tipos de canco do pâncreas podem ser divididos em dois grupos genéricos. A grande maioria dos casos (99%) ocorre na parte do pâncreas que produz enzimas digestivas, denominada componente exócrino. Embora existam vários subtipos de cancros pancreáticos exócrinos, o seu diagnóstico e tratamento são em grande parte semelhantes. A pequena minoria de cancros que surge no tecido produtor de hormonas (endócrino) apresenta características clínicas diferentes. Ambos os grupos ocorrem principalmente (mas não de forma exclusiva) em pessoas com mais de 40 anos e são ligeiramente mais comuns em homens. No entanto, alguns subtipos mais raros ocorrem principalmente em mulheres ou crianças.[16][17]
Cancros exócrinos
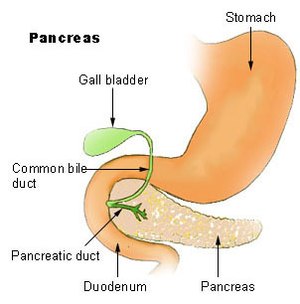
O grupo exócrino é dominado pelo adenocarcinoma pancreático, também denominado "invasivo" ou "ductal", que é de longe o tipo mais comum e corresponde a cerca de 85% de todos os cancros pancreáticos.[2] Por outro lado, o tecido a partir do qual se forma, o epitélio ductal pancreático, representa apenas 10% do volume de células do pâncreas.[18] Este cancro tem origem nos ductos que transportam determinadas hormonas e enzimas para fora do pâncreas. Cerca de 60–70% dos adenocarcinomas ocorrem na cabeça do pâncreas (ver diagrama)[2]
O segundo tipo mais comum, o carcinoma de células acinares, tem origem nos aglomerados de células que produzem estas enzimas, e correspondem a 5% de todos os cancros pâncreáticos exócrinos. Os carcinomas de células acinares podem causar sobre-produção de determinadas moléculas, neste caso de enzimas digestivas, que podem provocar sintomas como irritações cutâneas ou dores nas articulações. Os cistoadenocarcinomas correspondem a 1% dos cancros pancreáticos e apresentam melhor prognóstico do que os restantes tipos exócrinos.[19]
Os pancreatoblastomas são uma forma rara de cancro pancreático, que ocorre maioritariamente na infância e com prognóstico relativamente positivo. Entre outros cancros exócrinos raros estão os carcinomas adenoescamosos, os carcinomas de células em anel de sinete, os carcinomas hepatoides, carcinomas coloides, carcinomas indiferenciados com células gigantes do tipo osteoclasto. O tumor sólido pseudopapilar é uma neoplasia rara de baixo grau que afeta principalmente mulheres jovens e tem geralmente um prognóstico bastante positivo.[2][20] As neoplasias císticas mucinosas do pâncreas são um grupo alargado de tumores do pâncreas com diferente potencial de malignidade. Têm vindo a ser detectados com maior frequência devido à vulgarização e evolução das tomografias computorizdas em exames clínicos. Ainda se discute a melhor forma de tratamento, dado que a maior parte é beningna.[21]
Neuroendócrino
A pequena mioria de tumores que se forma nas restantes áreas do pâncreas são sobretudo tumores neuroendócrinos do pâncreas (PanNET).[22] Os tumores neuroendócrinos (NET) são um grupo diversificado de tumores beningnos ou malignos que se forma nas células neuroendócrinas, as quais são responsáveis pela integração do sistema nervoso e endócrino. Os NET podem-se formar na maior parte dos órgãos, incluindo o pâncreas, embora todos os tipos malignos sejam considerados raros. Os PanNET são agrupados em tipos "funcionais" e "não funcionais", dependendo do grau a que produzem hormonas. Os tipos funcionais segregam para a corrente sanguínea hormonas como a insulina, gastrina e glicagina, muitas vezes em grande quantidade, dando origem a sintomas graves como pouco açúcar no sangue, embora também favoreçam a deteção precoce da doença. Os PanNET mais comuns são os insulinomas e os gastrinomas, assim denominados de acordo com as hormonas que segregam. Os tipos não funcionais não segregam hormonas em quantidade suficiente para provocar sintomas clínicos visíveis. Por esta razão, muitas vezes os PanNET não funcionais só são diagnosticados depois de o cancro se ter disseminado para outras partes do corpo.[23]
Tal como com outros tumores neuroendócrinos, as história da terminologia e classificação dos PanNET é complexa.[22] Os PanNET são por vezes denominados "tumores de células das ilhotas",[24] embora hoje se saiba que não têm origem nas células das Ilhotas de Langerhans, como anteriormente se pensava.[23]
Sinais e sintomas

Uma vez que o cancro do pâncreas geralmente não produz sintomas visíveis durante as fases iniciais, na maioria dos casos a doença só é dianosticada quando já se disseminou para além do próprio pâncreas.[6] Isto é uma das principais razões que explica a baixa taxa de sobrevivência. No entanto, excluem-se deste cenário os PanNET, uma vez que a sobre-produção de várias hormonas ativas pode dar origem a sintomas, os quais dependem do tipo de hormonas.[25]
Tendo em conta que a doença raramente é diagnosticada antes dos 40 anos de idade, os sintomas mais comuns de adenocarcinoma pancreático pré-diagnóstico incluem:
- Dor na parte superior ou posterior do abdómen, que muitas vezes se prolonga à volta do estômago e até à costas. A localização da dor pode indicar a parte do pâncreas onde se situa o tumor. Esta dor pode agravar-se durante a noite e aumentar ao longo do tempo, tornando-se mais dolorosa e persistente. Pode ser ligeiramente aliviada quando a pessoa se dobra para a frente.[19]
- Icterícia, uma coloração amarelada da parte branca dos olhos ou da pele, com ou sem dor, e possivelmente em conjunto com urina mais escura do que o normal. Isto deve-se ao facto dos cancros na cabeça do pâncreas obstruírem o ducto colédoco na parte em que atravessa o pâncreas.[26]
- Perda inexplicável de peso, quer devido a perda de apetite como a má digestão.[3]
- O tumor pode comprimir os órgãos vizinhos, interferir com o processo digestivo e fazendo com que o estômago não se consiga esvaziar, o que pode provocar náuseas e a sensação de enfartamento. A gordura indigerida provoca fezes gordurosas e fedentas difícieis de escoar.[3] A obstipação é comum.[27]
- Pelo menos 50% das pessoas comadenocarcinoma pancreático têm diabetes no momento do diagnóstico.[2] Embora a diabetes seja um fator de risco conhecido para o cancro do pâncreas, o próprio cancro pode provocar a diabetes, pelo que o aparecimento recente da doença pode ser considerado um dos primeiros sinais da doença.[28] As pessoas com mais de 50 anos que desenvolvem diabetes apresentam um risco oito vezes superior de desenvolver adenocarcinoma pancreático no prazo de três anos, após os quais o risco diminui.[3]
Outras manifestações
- A síndrome de Trousseau, na qual se formam coágulos sanguíneos de forma espontânea nos vasos capilares portais ou nas veias superficiais de qualquer parte do corpo, pode estar associada ao canco do pâncreas e é observada em cerca de 10% dos casos.[5]
- Em cerca de 10-20% dos casos tem sido indicada depressão nervosa em associação com o cancro do pâncreas, o que pode constituir um obstáculo ao tratamento correto. Por vezes, a depressão aparece antes do diagnóstico de cancro, o que sugere que pode ser provocada pela biologia da doença.[5]
Entre outras manifestações comuns da doença estão a fraqueza e facilidade em se cansar; boca seca, problemas de sono; e uma massa abdominal palpável.[27]
Sintomas das metástases

A disseminação do cancro do pâncreas para outros órgãos (metástase) pode também causar sintomas. Geralmente, o adenocarcinoma pancreático começa por se propagar para os gânglios linfáticos nas proximidades, e posteriormente para o fígado, cavidade peritoneal, intestino grosso ou pulmões.[5] É pouco comum que se espalhe para os ossos ou cérebro.[29]
Os cancros pancreáticos podem também ser eles próprios cancros secundários que se propagaram a partir de outras partes do corpo. No entanto, esta é uma situação pouco comum, observada em apenas 2% dos casos de cancro pancreático. o cancro dos rins é, de longe, o cancro mais comum que se propaga para o pâncreas, seguido pelo cancro do cólon, melanoma e cancro da mama.[30]
Fatores de risco
Os fatores de risco para o adenocarcinoma pancreático incluem:[2][3][4][31]
- Idade, género e raca. O risco de desenvolver canco do pâncreas aumenta com a idade. A maior parte dos casos ocorre após os 65 anos,[4] enquanto que os casos em idades inferiores a 40 anos são pouco comuns. A doença é ligeiramente mais comum em homens do que em mulheres e, nos Estados Unidos, é 1,5 vezes mais comum entre a população afro-americana, embora a incidência em África seja baixa.[4]
- O tabagismo é o fator de risco mais facilmente evitável para o cancro do pâncreas. O risco é duas vezes superior entre fumadores de longa data, risco esse que aumenta de acordo com o número de cigarros fumados por dia e os anos de vício. O risco decresce ligeramente após cessação tabágica, levando cerca de 20 anos para se aproximar do risco entre não fumadores.[32]
- Obesidade; um IMC superior a 35 aumenta o risco relativo em cerca de metade.[3]
- Historial familiar; 5–10% dos casos de cancro do pâncreas têm um componente hereditário, em que as pessoas têm histórico familiar de cancro pancreático.[2] O risco aumenta de forma significativa se mais de um parente em primeiro grau teve a doença, e de forma moderada caso a tenham desenvolvido antes dos 50 anos de idade.[6] A maior parte dos genes envolvidos nesta questão ainda não foi identificada.[2][33] A pancreatite hereditária proporciona um risco bastante agravado (30-40%) de ao longo da vida vir a desenvolver cancro do pâncreas até aos 70 anos de idade.[5] É possível que a este grupo possa ser oferecido rastreio precoce de cancro do pâncreas com finalidade de investigação.[34] Algumas pessoas podem optar por remover circurgicamente o pâncreas de modo a evitar o aparecimento de cancro no futuro.[5]
- A diabetes é um fator de risco para cancro do pâncreas e o seu aparecimento pode ser um sinal precoce da doença. As pessoas diagnosticadas com diabetes do tipo 2 há mais de dez anos têm um risco acrescido em 50%, em comperação com os não diabéticos.[5]
- A pacreatite crónica aparenta triplicar o risco e, tal como no caso da diabetes, o aparecimento de pancreatite pode ser um sintoma de um tumor.[5] O risco de cancro do pâncreas em indivíduos com historial familiar de pacreatite é particularmente elevado.[5][33]
- Para muitos dos alimentos, não há indícios claros de que aumentem o risco de cancro do pâncreas..[2] No entanto, há evidências de que possa haver um risco ligeiramente superior derivado do consumo de carne vermelha, carne processafa e carne cozinhada a temperatura muito alta (p.e. frita ou grelhada).[35][36]
- O cancro pancreático tem tembém sido associado aos seguintes síndromes hereditários raros: síndrome de Peutz–Jeghers devido a mutações no gene supressor de tumor STK11 (bastante raro, embora um fator de risco significativo); síndrome familiar do nevo displásico devido a mutações no gene supressor de tumor CDKN2A; ataxia telangiectasia autossómica recessiva e mutações autossómicas dominantes hereditárias nos genes BRCA2 e PALB2; Cancro colorretal hereditário sem polipose; E polipose adenomatosa familiar. Os PanPET têm sido associados com Neoplasia adócrina múltipla do tipo 1 e com o síndrome de Von Hippel-Lindau.[2][5][6]
Bebidas alcoolicas
O consumo de álcool em excesso é uma das principais causas de pacreatite crónica, a qual predispõe a pessoa para o cancro pancreático. No entanto, apesar de uma quantidade considerável de investigação, não se conseguiu estabelecer de forma inequívoca o consumo de álcool como um fator de risco direto para o cancro pancreático. De forma geral, a associação é consistentemente fraca e a maioria dos estudos não encontrou qualquer associação, embora o tabagismo seja uma forte variável de confusão. As evidências são mais fortes nos casos de consumo pesado, de pelo menos seis bebidas por dia.[5][37]
Diagnóstico
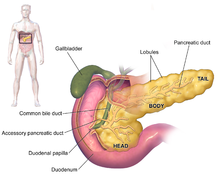

Os sintomas de adenocarcinoma pancreático geralmente não se manifestam durante as fases iniciais da doença e, indivdualmente, não são exclusivos da doença.[3][5][26] Os sintomas no momento do diagnóstico variam de acordo com a localização do cancro no pâncreas, que os anatomistas dividem em cabeça, pescoço, corpo e cauda. Cerca de 60–70% dos cancros pancreáticos localizam-se na cabeça do pâncreas.[2] O sintoma mais comum, qualquer que seja a localização, é a perda inexplicável de peso, que pode ser considerável. Os tumores na cabeça da glândula também provocam icterícia, dores abdominais, perda de apetita, urina escura e fezes de cor clara. Os tumores no corpo e na cauda geralmente também provocam dor. Numa grande minoria das pessoas diagnosticadas (entre 35 e 47%), também estão presentes, qualquer que seja a localização do tumor, náuseas, vómitos e sensação de raqueza.[26]
No momento de diagnóstico, por vezes as pessoas têm historial recente de diabetes do tipo 2 de difícil controlo, historial recente e inexplicável de inflamação dos vasos capilares provocada por coágulos sanguíneos (sinal de Trousseau), ou um ataque anterior de pancreatite.[26] O médico poderá suspeitar de cancro do pâncreas quando o aparecimento de diabetes num indivíduo com mais de 50 anos é acompanhado por sintomas característicos, como perda inexplicável de peso, dor abdominal ou das costas persistente, indigestão, vómitos ou fezes gordurosas.[3] Também a icterícia, quando acompanhada por inflamação indolor da vesícula biliar (sinal de Courvoisier), pode levantar suspeitas e pode ajudar a diferenciar o cancro pancreático de pedras na vesícula.[38]
As técnicas de imagiologia médica, como a tomografia computadorizada ou ecoendoscopia, são usadas para confirmar o diagnóstico e ajudar a decidir se o tumor pode ou não ser removido com cirurgia.[3] É também possível recorrer a imagem por ressonância magnética ou tomografia por emissão de positrões,[2] e nalguns casos a colangiopancreatografia.[26] A ecografia abdominal é menos sensível e pode não detetar pequenos tumores, embora possa identificar cancros que se tenham propagado para o fígado e a acumulação de fluido na cavidade peritoneal (ascites).[3] It may be used for a quick and cheap first examination before other techniques.[39] Nos casos em que não há certeza sobre o diagnóstico, pode ser realizada uma biópsia através de punção aspirativa por agulha fina, geralmente orientada por ecografia endoscópica. No entanto, geralmente não é necessário um diagnóstico histológico para decidir a remoção do tumor através de cirurgia.[3]
Os testes de função hepática podem mostrar uma combinação de resultados indicativos de uma obstrução do ducto biliar (quantidade acima do normal de bilirrubina, gamaglutamiltranspeptidase e fosfatase alcalina). o antígeno carboidrato 19-9 (CA 19-9)é um marcador tumoral que geralmente se encontra elevado em casos de canco do pâncreas. No entanto, este indicador tem pouca sensibilidade, uma vez que 5% das pessoas não têm o antígeno de Lewis (a) e não produzem o CA 19-9, pelo que é usado principalmente para acompanhar casos já diagnosticados e não para o diagnóstico em si.[2][3]
Quando observada ao microscópio, a forma mais comum de cancro do pâncreas (adenocarcinoma) é geralmente caracterizada por estruturas glandulares pouco ou moderadamente diferenciadas. Normalmente, verifica-se desmoplasia considerável ou formação de um estroma ou tecido estrutural constituído por uma gama diversa de tipos celulares (incluindo miofibroblastos, macrófagos, linfócitos e mastócitos) e material depositado (colagénio do tipo I e ácido hialurónico. Isto proporciona um microambiente no tumor com pouca quantidade de vasos sanguíneos (hipovascular) e de oxigénio (hipóxia tumoral).[2] Pensa-se que este ambiente seja o que impeça muitos dos fármacos de quimioterapia de atingir o tumor, o que é um dos fatores que torna o tratamento deste cancro particularmente difícil.[2][5]
Tratamento
Cancro exócrino
Uma das principais avaliações feita após o diganóstico é se possível ou não a remoção do tumor por via cirúrgica, uma vez que esta é a única cura para este tipo de cancro. A possibilidade de remoção depende de quanto é que o cancro se propagou. A localização exata do tumor é também um fator significativo, pelo que a TAC pode mostrar como é que o tumor se relaciona com os principais vasos sanguíneos que passam na proximidade do pâncreas. Também deve ser avaliado o estado de saúde geral da pessoa, embora a idade por si só não seja um obstáculo para a cirurgia.[5] Sempre que não é possível a realização da cirurgia, à maior parte das pessoas é oferecida a opção de realizar quimioterapia e, ainda que menos frequente, radioterapia. Os especialistas recomendam que o tratamento do cancro do pâncreas seja realizado por uma equipa multidisciplinar que inclua especialistas em diversas áreas de oncologia, pelo que é geralmente realizado em centros hospitalares de grande dimensão.[2][5]
Cirurgia

A cirurgia com a intenção de cura só é possível em cerca de 20% dos novos casos.[3] Embora as TAC ajudem, na prática pode ser bastante difícil determinar se o tumor pode ou não ser completamente removido. É ainda possível que só na própria cirurgia é que se torne aparente que não será possível remover de forma bem-sucedida o tumor sem danificar outros tecidos vitais. A possibilidade de poder oferecer, ou não, a remoção cirúrgica depende de vários fatores, entre os quais a dimensão precisa do tumor ou quantos vasos sanguíneos venosos ou arteriais estão envolvidos,[2] assim como a avaliação da perícia cirúrgica necessária e da previsão rigorosa da recuperação pós-operatória.[40][41] A idade da pessoa não é em si uma razão para não operar, mas a sua performance precisa de ser adequada a uma grande operação.[3]
Uma característica peculiar que é procurada é a presença encorajadora, ou ausência desencorajadora, de uma camada de gordura que atue como barreira entre o tumor e os vasos sanguíneos.[5] Por norma, é feita uma avaliação da proximidade do tumor em relação aos principais vasos arteriais ou venosos. Esta avaliação verifica se o tumor apenas toca no vaso até ao limite de metade da sua circunferência, se o tumor envolve a maior parte da circunferência do vaso, ou se o tumor envolve por completo o vaso.[42] Em alguns casos, pode ser possível remover secções envoltas de vasos sanguíneos,[43][44] sobretudo quando é possível proceder a terapia neoadjuvante,[45][46][47] usando quimioterapia[41][42][48] e/ou radioterapia.[42]
Mesmo nos casos em que a operação aparenta ter sido bem sucedida, durante o exame microscópico posterior são muitas vezes encontradas células cancerígenas na periferia dos tecidos removidos, o que indica que o canco possa não ter sido completamente removido.[2] Para além disso, as células estaminais cancerígenas são pouco evidentes ao microscópio e, caso estejam presentes, podem continuar a desenvolver-se e propagar-se.[49][50] Para obter dados claros sobre o resultado pós-operatório, é possível realizar uma laparoscopia, uma pequena intervenção cirúrgica guiada por uma câmara.[51]

Nos cancros que envolvem a cabeça do pâncreas, o procedimento de Whipple é o tratamento cirúrgico curativo mais comum. Esta operação consiste na remoção em simultâneo da cabeça do pâncreas e da curva do dudodeno ("duodenopancreatectomia"), na criação de um bypass para os alimentos desde o estômago até ao jejuno ("gastro-jejunostomia") e na ligação do jejuno ao ducto cístico para drenar a bílis ("colecisto-jejunostomia"). Este procedimento só pode ser realizado caso a pessoa tenha condições de sobreviver a uma intervenção cirúrgica de risco e quando o cancro não invade estruturas locais ou apresenta metástases, pelo que só é possível numa minoria de casos. Os cancros da cauda do pâncreas podem ser removidos através de um procedimento denominado pancreatectomia discal, que em muitos casos implica também a remoção do baço.[2][5] Hoje em dia, este procedimento pode ser feito através de métodos minimamente invasivos.[2][5]
Embora a cirurgia com finalidade curativa já não esteja associada às elevadas taxas de mortalidade que ocorriam até à década de 1980, uma proporção significativa dos doentes (30–45%) continua a necessitar de tratamento para doenças pós-operatórias que não são provocadas pelo cancro em si. A complicação mais comum da cirurgia é a dificuldade em esvaziar o estômago.[5] Podem ainda ser utilizados alguns procedimentos cirúrgicos para aliviar determinados sintomas. Por exemplo, se o cancro estiver a invadir ou comprimir o duodeno ou o intestino grosso, um bypass pode reverter a obstrução e melhorar significativamente a qualidade de vida, embora a intervenção não se destine à cura.[3]
Quimioterapia
Após a cirurgia e um período de recobro de um ou dois meses, pode ser oferecida à pessoa a possibilidade de quimioterapia adjuvante com gencitabina ou 5-FU, desde que esteja apta fisicamente.[6][39] Em pessoas que não estejam aptas a receber cirurgia curativa, a quimioterapia pode ser usada para melhorar a qualidade de vida.[5] Em casos considerados limitrofes em relação à possibilidade de remoção, é possível recorrer a quimioterapia neoadjuvante ou quimioradioterapia de modo a reduzir o cancro até a um nível em que se possa proceder à cirurgia. Nos restantes casos, a terapia neoadjuvante permanece controversa, uma vez que atrasa a cirurgia.[5][6][52]
A gencitabina foi aprovada nos Estados Unidos em 1997, após um ensaio clínico ter verificado a melhorias na qualidade de vida e um prolongamento de cinco semanas na duração média de sobrevivência em pessoas com cancro pancreático avançado.[53] A quimioterapia unicamente com gencitabina foi a norma durante uma década, uma vez que as combinações com outros fármacos não demonstraram resultados significativamente melhores. No entanto, verificou-se que a combinação de gencitabina com erlotinibe aumentava ligeiramente a sobrevivência, tendo esta última sido licenciada para uso em cancro do pâncreas nos Estados Unidos em 2005.[54]
Verificou-se também que o protocolo para tratamento da quimioterapia FOLFIRINOX, que é uma combinação de quatro fármacos, é mais eficaz que a gencitabina. No entanto, possui também efeitos secundários significativos, pelo que só é adequado a pessoas devidamente aptas. Este é também o caso do paclitaxel ligado a proteína (nab-paclitaxel), licenciado pela primeira vez em 2013 para o uso com gencitabina em cancros do pâncreas.[55] Por volta do final de 2013, tanto o FOLFIRINOX como o nab-paclitaxel com gencitabina eram vistos como boas escolhas para pessoas capazes de tolerar os efeitos secundários, enquanto a gencitabina isolada continuava a ser uma opção eficaz para pessoas que não o eram. Está por realizar um ensaio que compare diretamente as duas opções, continuando a ser investigadas outras possíveis combinações. No entanto, as inovações introduzidas nos últimos anos apenas prolongaram o tempo médio de sobrevivência por alguns meses.[53][6]
Radioterapia
A radioterapia pode ser usada como parte do tratamento com o intuito de reduzir o tumor até uma dimensão operável, embora o seu uso em tumores inoperáveis permaneça controverso, uma vez que os resultados dos ensaios são contraditórios.[2] Desde a década de 1980 que o uso de radioterapia enquanto tratamento adjuvante após cirurgia potencialmente curativo tem sido também controverso.[5] A Sociedade Europeia de Oncologia Médica recomenda que a radioterapia adjuvante seja usada apenas em pessoas inscritas em ensaios clínicos.[39] No entanto, há uma crescente tendência entre médicos nos Estados Unidos para o uso de radioterapia. Desde a década de 1980 que vários ensaios clínicos têm testado diversas combinações de tratamentos, mas não existem ainda conclusões definitivas.[5][6]
PanNETs
O tratamento de tumores neuroendócrinos pancreáticos (PanNET), incluindo os tipos malignos menos comuns, pode ser realizado através de diversas abordagens.[56][57][58][59] Alguns tumores de pequena dimensão (< 1 cm) que sejam identificados acidentalmente (por exemplo, durante uma TAC), podem continuar a ser vigiados até haver eventuais alterações significativas.[56] Isto depende da avaliação do risco de cirurgia, o qual é inflenciado pela lozalização do tumor e da presença de outros problemas médicos.[56] Os tumores que estejam situados apenas no pâncreas (tumores localizados) ou com poucas metástases (por exemplo, apenas no fígado), podem ser removidos cirurgicamente. O tipo de cirurgia depende da localização do tumor e do grau de afetação dos gânglios linfáticos.[17]
No caso de tumores localizados, os procedimentos cirúrgicos podem ser muito menos intrusivos do que os tipos de cirurgia usados no tratamento de adenocarcinomas pancreáticos descritos acima. O prognóstico varia imenso; alguns tipos têm uma taxa de sobrevivência bastante elevada após a cirurgia, enquanto para outros o prognóstico é reservado. Uma vez que este grupo de tumores é raro, as recomendações salientam que o tratamento deve ser realizado num centro hospitalar especializado.[23][17] Em determinados casos onde existem metástases no fígado, pode ser considerado um transplante hepático.[60]
Em casos de tumores funcionais, a classe de medicamentos análogos da somatostatina, como a octreotida, pode reduzir a produção excessiva de hormonas.[17] O lanreotide pode atrasar o crescimento do tumor.[61] Se o tumor não permite remoção cirúrgica e provoca sintomas, esses sintomas podem ser diminuídos através de terapia orientada com everolimo ou sunitinib, atrasando o avanço da doença.[23][62][63] A quimioterapia citotóxica padrão é geralmente pouco eficaz no caso dos PanNET, mas pode ser usada quando os outros tratamentos não impedem a progressão da doença,[23][64] ou em cancros PanNET pouco diferenciados.[65]
A radioterapia é ocasionalmente usada quando se verifica dor por extensão anatómica, como no caso de metástases nos ossos. Alguns PanNET absorvem hormonas ou peptídeos específicos, podendo responder à terapia de medicina nuclear com peptídeos ou hormonas com radiomarcação, como o iobenguano.[66][67][68][69] Podem também ser utilizadas ablação por radiofrequência, crioablação e embolização da artéria hepática.[70][71]
Cuidados paliativos
Cuidados paliativos é a prestação de cuidados de saúde focada no tratamento de sintomas de doenças graves, como o cancro, e na melhoria da qualidade de vida.[72] Uma vez que o adenocarcinoma pancreático geralmente só é diagnosticado quando já se encontra numa fase avançada, os cuidados paliativos são muitas vezes o único tratamento possível.[73] Os cuidados paliativos focam-se no tratamento de sintomas como a dor ou náuseas, e podem auxiliar a tomade de decisões, incluindo quando ou se é necessário o internamento numa unidade dedicada.[74]
A dor pode ser tratada com medicamentos como os opiáceos ou através de intervenções cirúrgicas, como o bloqueio de nervos no plexo solar. Este procedimento altera ou, dependendo da técnica, destrói os nervos que transmitem dor a partir do abdómen, constituindo uma forma segura e eficaz de reduzir a dor, reduzindo também a necessidade de analgésicos ou opiáceos, os quais têm efeitos adversos significativos.[5][75]
Outros sintomas ou complicações que podem ser tratados com cirurgia paliativa são obstruções por parte do tumor dos intestinos ou dos ductos biliares. Neste último caso, que ocorre em mais de metade dos casos de cancro pancreático, é inserido por via endoscópica um stent metálico que mantém a drenagem dos ductos.[26] Os cuidados paliativos também podem ajudar a tratar a depressão associada ao diagnóstico de cancro do pâncreas.[5]
Tanto a cirurgia como os tumores inoperáveis levam muitas vezes a distúrbios no aparelho digestivo, causadas pela ausência de produtos exócrinos no pâncreas (insuficiência exócrina). Estes distúrbios podem ser tratados com pancreatina, um medicamento que contém enzimas pancreáticas sintéticas.[3] A dificuldade em esvaziar o estômago é comum é pode ser um problema grave que necessita de hospitalização. O tratamento pode envolver uma série de abordagens, incluindo a drenagem do estômago por aspiração nasogástrica e por fármacos denominados inibidores da bomba de protões ou antagonistas do receptor H2, os quais reduzem a produção de ácido gástrico.[3]
Prognóstico
O adenocarcinoma pancreático e os menos comuns cancros exócrinos apresentam um prognóstico bastante reservado, uma vez que geralmente só são diagnosticados em fases avançadas e quando o cancro já tem uma dimensão considerável ou se propagou para outras partes do corpo.[2] No caso dos PanNET, o prognóstico é superior, uma vez que muitos são benignos e não apresentam quaisquer sintomas clínicos, e mesmo os casos incuráveis apresnetam uma taxa de sobrevivência aos cinco anos superior a 16%.[76] No entanto, o prognóstico varia consideravelmente em função do tipo.[25]
No caso dos denocarcinomas pancreáticos já avançados ou com metástases, que juntos representam 80% dos casos, os diversos ensaios recentes que compararam os regimes de quimioterapia demonstraram uma melhoria no tempo média de osbrevivência, embora não seja superior a um ano.[2][53] Por exemplo, nos Estadus Unidos, a taxa de sobrevivência ao quinto ano era de 2% entre 1975 e 1977, melhorando para 4% entre 1987 e 1989 e para 6% entre 2003 e 2009.[77] Nos restantes 20% de casos de adenocarcinoma pancreático com diagnóstico localizado e de pequeno crescimento (<2 cm e estágio T1), cerca de 20% dos norte-americanos sobrevive para além dos cinco anos.[15]
História
Os primeiros estudos feitos por Morgagni em 1761 são de grande relevância histórica. Outros estudos no século XIX podem ser citados como os de Mondière (1836), Bigsby (1854) e Da Costa (1858). Com relação à cirurgia, Halsted realizou a primeira ressecção (1899) e Alan Oldfather Whipple, em seu estudo publicado em 1935, descreveu a técnica usada ainda hoje, chamada de "Cirurgia de Whipple" ou duodenopancreatectomia cefálica. Mais tarde Transverso e Longmire (1978) modificaram a técnica.
Referências
- ↑ National Institutes of Health (7 de março de 2014). «What is Cancer? Defining Cancer». National Cancer Institute. Consultado em 5 de dezembro de 2014
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Ryan DP, Hong TS, Bardeesy N (Setembro de 2014). «Pancreatic adenocarcinoma» (PDF). N. Engl. J. Med. 371 (11): 1039–49. PMID 25207767. doi:10.1056/NEJMra1404198
- ↑ a b c d e f g h i j k l m n o p q r s Bond-Smith G, Banga N, Hammond TM, Imber CJ (2012). «Pancreatic adenocarcinoma» (PDF). BMJ (Clinical research ed.). 344: e2476. PMID 22592847. doi:10.1136/bmj.e2476
- ↑ a b c d e f g h i «5.7». World Cancer Report 2014. [S.l.]: Organização Mundial de Saúde. 2014. ISBN 92-832-0429-8
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH (Setembro de 2013). «Recent progress in pancreatic cancer». CA: a Cancer Journal for Clinicians. 63 (5): 318–48. PMC 3769458
 . PMID 23856911. doi:10.3322/caac.21190
. PMID 23856911. doi:10.3322/caac.21190
- ↑ a b c d e f g h Vincent A, Herman J, Schulick R, Hruban RH, Goggins M (Agosto de 2011). «Pancreatic cancer» (PDF). Lancet. 378 (9791): 607–20. PMID 21620466. doi:10.1016/S0140-6736(10)62307-0
- ↑ Bussom S, Saif MW (5 de março de 2010). «Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010». JOP : Journal of the pancreas. 11 (2): 128–30. PMID 20208319
- ↑ «Can pancreatic cancer be prevented?». American Cancer Society. 11 de junho 2014. Consultado em 13 de novembro de 2014
- ↑ «Pancreatic Cancer Treatment (PDQ®) Patient Version». National Cancer Institute. National Institutes of Health. 17 de abril de 2014. Consultado em 8 de junho de 2014
- ↑ Shahrokni A, Saif MW (10 de julho de 2013). «Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life». JOP : Journal of the pancreas. 14 (4): 391–4. PMID 23846935. doi:10.6092/1590-8577/1663
- ↑ Bardou M, Le Ray I (December 2013). «Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies». Best practice & research. Clinical gastroenterology. 27 (6): 881–92. PMID 24182608. doi:10.1016/j.bpg.2013.09.006 Verifique data em:
|data=(ajuda) - ↑ Hariharan D, Saied A, Kocher HM (2008). «Analysis of mortality rates for pancreatic cancer across the world». HPB. 10 (1): 58–62. PMC 2504856
 . PMID 18695761. doi:10.1080/13651820701883148
. PMID 18695761. doi:10.1080/13651820701883148
- ↑ «Lifetime Risk of Developing or Dying From Cancer». American Cancer Society. 1 de outubro de 2014. Consultado em 1 de dezembro de 2014
- ↑ «Cancer Facts & Figures 2010» (PDF). American Cancer Society. 2010. Consultado em 5 de dezembro de 2014
- ↑ a b «Pancreatic Cancer Treatment (PDQ®) Health Professional Version». National Cancer Institute. National Institutes of Health. 21 de fevereiro de 2014. Consultado em 24 de novembro de 2014
- ↑ Harris, RE (2013). «Epidemiology of pancreatic cancer». Epidemiology of Chronic Disease. [S.l.]: Jones & Bartlett. pp. 181–190. ISBN 978-0-7637-8047-0
- ↑ a b c d Öberg K, Knigge U, Kwekkeboom D, Perren A (Outubro de 2012). «Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO. 23 Suppl 7: vii124–30. PMID 22997445. doi:10.1093/annonc/mds295
- ↑ Govindan R (2011). «Chapter 35: Cancer of the Pancreas: Surgical Management». DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology 9ª ed. [S.l.]: Lippincott Williams & Wilkins. ISBN 978-1-4511-0545-2
- ↑ a b Tobias JS, Hochhauser D (2010). Cancer and its Management 6th ed. [S.l.: s.n.] pp. 276–7. ISBN 978-1-1187-1325-9
- ↑ «Types of Pancreas Tumors». The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Consultado em 18 de novembro de 2014
- ↑ Farrell JJ, Fernández-del Castillo C (June 2013). «Pancreatic cystic neoplasms: management and unanswered questions». Gastroenterology. 144 (6): 1303–15. PMID 23622140. doi:10.1053/j.gastro.2013.01.073 Verifique data em:
|data=(ajuda) - ↑ a b A denominação PanNET está de acordo com as recomendações da OMS para a classificação de tumores do sistema digestivo publicadas em 2010. Anteriormente, os PanNET eram referidos por diversos termos, sendo ainda hoje frequentemente denominados "tumores endócrinos pancreáticos". Ver: Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S (Agosto de 2010). «The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems» (PDF). Pancreas. 39 (6): 707–12. PMID 20664470. doi:10.1097/MPA.0b013e3181ec124e
- ↑ a b c d e Burns WR, Edil BH (Março de 2012). «Neuroendocrine pancreatic tumors: guidelines for management and update». Current treatment options in oncology. 13 (1): 24–34. PMID 22198808. doi:10.1007/s11864-011-0172-2
- ↑ O sistema de indexação Medical Subject Headings menciona "tumores de células das ilhotas", que se divide em gastrinoma, glucagonoma, somatostatinoma e VIPoma. Ver "Pancreatic Neoplasms [C04.588.322.475]" 16 October 2014
- ↑ a b «Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas». The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Consultado em 5 de janeiro de 2015
- ↑ a b c d e f De La Cruz MS, Young AP, Ruffin MT (Abril de 2014). «Diagnosis and management of pancreatic cancer». Am Fam Physician. 89 (8): 626–32. PMID 24784121
- ↑ a b Alberts, SR; Goldberg, RM (2009). «Chapter 9: Gastrointestinal tract cancers». In: Casciato, DA; Territo, MC. Manual of clinical oncology. [S.l.]: Lippincot Williams & Wilkins. pp. 188–236. ISBN 9780781768849
- ↑ Pannala R, Basu A, Petersen GM, Chari ST (janeiro de 2009). «New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer». The Lancet. Oncology. 10 (1): 88–95. PMC 2795483
 . PMID 19111249. doi:10.1016/S1470-2045(08)70337-1
. PMID 19111249. doi:10.1016/S1470-2045(08)70337-1
- ↑ «Chapter 15; Pancreas». Manual for Staging of Cancer (PDF) 2ª ed. [S.l.]: American Joint Committee on Cancer. pp. 95–8
- ↑ Sperti C, Moletta L, Patanè G (15 de outubro de 2014). «Metastatic tumors to the pancreas: The role of surgery». World journal of gastrointestinal oncology. 6 (10): 381–92. PMID 25320654
- ↑ «Causes of pancreatic cancer». NHS Choices. National Health Service, England. 7 de outubro de 2014. Consultado em 5 de dezembro de 2014
- ↑ Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji BT, Negri E, Li D, Risch HA, Olson SH, Gallinger S, Miller AB, Bueno-de-Mesquita HB, Talamini R, Polesel J, Ghadirian P, Baghurst PA, Zatonski W, Fontham E, Bamlet WR, Holly EA, Bertuccio P, Gao YT, Hassan M, Yu H, Kurtz RC, Cotterchio M, Su J, Maisonneuve P, Duell EJ, Boffetta P, La Vecchia C (Julho de 2012). «Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4)». Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 23 (7): 1880–8. PMID 22104574. doi:10.1093/annonc/mdr541
- ↑ a b Reznik R, Hendifar AE, Tuli R (2014). «Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma». Front Physiol. 5: 87. PMC 3939680
 . PMID 24624093. doi:10.3389/fphys.2014.00087
. PMID 24624093. doi:10.3389/fphys.2014.00087
- ↑ Greenhalf W, Grocock C, Harcus M, Neoptolemos J (2009). «Screening of high-risk families for pancreatic cancer». Pancreatology. 9 (3): 215–22. PMID 19349734. doi:10.1159/000210262
- ↑ «Cancer Facts and Figures 2014» (PDF). American Cancer Society. Consultado em 5 de janeiro de 2015
- ↑ Larsson SC, Wolk A (Janeiro de 2012). «Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies». Br J Cancer. Online first (3): 603–7. PMC 3273353
 . PMID 22240790. doi:10.1038/bjc.2011.585
. PMID 22240790. doi:10.1038/bjc.2011.585
- ↑ Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME (Janeiro de 2014). «Nutrition and pancreatic cancer.». Anticancer research. 34 (1): 9–21. PMID 24403441
- ↑ Fitzgerald JE, White MJ, Lobo DN (Abril de 2009). «Courvoisier's gallbladder: law or sign?» (PDF). World Journal of Surgery. 33 (4): 886–91. PMID 19190960. doi:10.1007/s00268-008-9908-y
- ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeESMOPA - ↑ Gurusamy KS, Kumar S, Davidson BR, Fusai G (2014). «Cochrane Database of Systematic Reviews». The Cochrane database of systematic reviews. 2: CD010244. PMID 24578248. doi:10.1002/14651858.CD010244.pub2
- ↑ a b Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J (2011). «Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis». Annals of Surgery. 254 (6): 882–93. PMID 22064622. doi:10.1097/SLA.0b013e31823ac299
- ↑ a b c «Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015» (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 4 de dezembro de 2014. Consultado em 26 de dezembro de 2014
- ↑ Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, Gómez MA, Muntané J, Padillo FJ (2014). «Improving outcomes in pancreatic cancer: key points in perioperative management». World J. Gastroenterol. 20 (39): 14237–45. PMC 4202352
 . PMID 25339810. doi:10.3748/wjg.v20.i39.14237
. PMID 25339810. doi:10.3748/wjg.v20.i39.14237
- ↑ Lopez NE, Prendergast C, Lowy AM (2014). «Borderline resectable pancreatic cancer: definitions and management». World J. Gastroenterol. 20 (31): 10740–51. PMC 4138454
 . PMID 25152577. doi:10.3748/wjg.v20.i31.10740
. PMID 25152577. doi:10.3748/wjg.v20.i31.10740
- ↑ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (2014). «Neoadjuvant strategies for pancreatic cancer». World J. Gastroenterol. 20 (28): 9374–83. PMC 4110569
 . PMID 25071332. doi:10.3748/wjg.v20.i28.9374
. PMID 25071332. doi:10.3748/wjg.v20.i28.9374
- ↑ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J (2010). «Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages». PLoS Med. 7 (4): e1000267. PMC 2857873
 . PMID 20422030. doi:10.1371/journal.pmed.1000267
. PMID 20422030. doi:10.1371/journal.pmed.1000267
- ↑ Christians KK, Evans DB (2014). «Additional Support for Neoadjuvant Therapy in the Management of Pancreatic Cancer». Ann. Surg. Oncol. PMID 25519932. doi:10.1245/s10434-014-4307-0
- ↑ Tsvetkova EV, Asmis TR (2014). «Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?». Curr Oncol. 21 (4): e650–7. PMC 4117630
 . PMID 25089113. doi:10.3747/co.21.2006
. PMID 25089113. doi:10.3747/co.21.2006
- ↑ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY (2015). «Pancreatic cancer stem cells: New insight into a stubborn disease». Cancer Lett. 357 (2): 429–37. PMID 25499079. doi:10.1016/j.canlet.2014.12.004
- ↑ Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R (2014). «Cancer stem cells: Involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics». World Journal of Gastroenterology. 20 (31): 10790-801. PMC 4138459
 . PMID 25152582. doi:10.3748/wjg.v20.i31.10790
. PMID 25152582. doi:10.3748/wjg.v20.i31.10790
- ↑ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (2013). «Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer». Cochrane Database Syst Rev. 11: CD009323. PMID 24272022. doi:10.1002/14651858.CD009323.pub2
- ↑ Heinemann V, Haas M, Boeck S (Outubro de 2013). «Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer.». Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 24 (10): 2484–92. PMID 23852311
- ↑ a b c Thota R, Pauff JM, Berlin JD (Janeiro de 2014). «Treatment of metastatic pancreatic adenocarcinoma: a review». Oncology (Williston Park, N.Y.). 28 (1): 70–4. PMID 24683721
- ↑ «Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride». National Cancer Institute. National Institutes of Health. 3 de julho de 2013. Consultado em 5 de dezembro de 2014
- ↑ Borazanci E, Von Hoff DD; Von Hoff, DD (Setembro de 2014). «Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer». Expert Rev Gastroenterol Hepatol. 8 (7): 739–47. PMID 24882381. doi:10.1586/17474124.2014.925799
- ↑ a b c «Neuroendocrine tumors, NCCN Guidelines Version 1.2015» (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 11 de novembro de 2014. Consultado em 25 de dezembro de 2014
- ↑ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, Salazar R, Taal BG, Vullierme MP, O'Toole D (2012). «ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors». Neuroendocrinology. 95 (2): 120–34. PMID 22261872. doi:10.1159/000335587
- ↑ Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R (2012). «ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes». Neuroendocrinology. 95 (2): 98–119. PMC 3701449
 . PMID 22261919. doi:10.1159/000335591
. PMID 22261919. doi:10.1159/000335591
- ↑ Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R (2012). «ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary». Neuroendocrinology. 95 (2): 157–76. PMID 22262022. doi:10.1159/000335597
- ↑ Rossi RE, Massironi S, Conte D, Peracchi M (2014). «Therapy for metastatic pancreatic neuroendocrine tumors». Annals of Translational Medicine. 2 (1): 8. PMID 25332984. doi:10.3978/j.issn.2305-5839.2013.03.01
- ↑ Nick Mulcahy (17 de dezembro de 2014). «FDA Approves Lanreotide for Neuroendocrine Tumors». Medscape Medical News. WebMD LLC. Consultado em 25 d edezembro de 2014 Verifique data em:
|acessodata=(ajuda) - ↑ «Everolimus Approved for Pancreatic Neuroendocrine Tumors.». The ASCO Post. 2 (8). 15 de maio de 2011
- ↑ National Cancer Institute. Cancer Drug Information. «FDA Approval for Sunitinib Malate. Pancreatic Neuroendocrine Tumors»
- ↑ Tejani MA, Saif MW (2014). «Pancreatic neuroendocrine tumors: Does chemotherapy work?». JOP: Journal of the pancreas. 15 (2): 132–4. PMID 24618436. doi:10.6092/1590-8577/2301
- ↑ Benson AB, Myerson RJ, Sasson AR. «Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010.». ISBN 978-0-615-41824-7
- ↑ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C (2012). «Radionuclide therapy in neuroendocrine tumours: A systematic review». Clinical Oncology. 24 (4): 294–308. PMID 22221516. doi:10.1016/j.clon.2011.12.003
- ↑ Vinik AI (2014). «Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS)». Endocrine Practice. 20 (11): 1–23. PMID 25297671. doi:10.4158/EP14373.RA
- ↑ Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP (2010). «Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors». Seminars in Nuclear Medicine. 40 (2): 78–88. PMID 20113677. doi:10.1053/j.semnuclmed.2009.10.004
- ↑ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G (2014). «Peptide receptor radionuclide therapy for advanced neuroendocrine tumors». Thoracic Surgery Clinics. 24 (3): 333–49. PMID 25065935. doi:10.1016/j.thorsurg.2014.04.005
- ↑ Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E (2014). «Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors». Cancer Chemotherapy and Pharmacology. PMID 25480314. doi:10.1007/s00280-014-2642-2
- ↑ Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C (2014). «Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group». Annals of Surgical Oncology. PMID 25366583. doi:10.1245/s10434-014-4145-0
- ↑ «Palliative or Supportive Care». American Cancer Society. 2014. Consultado em 20 de agosto de 2014
- ↑ Buanes TA (14 de agosto de 2014). «Pancreatic cancer-improved care achievable». World journal of gastroenterology : WJG. 20 (30): 10405–18. PMID 25132756. doi:10.3748/wjg.v20.i30.10405
- ↑ «If treatment for pancreatic cancer stops working». American Cancer Society. 11 de junho de 2014. Consultado em 20 de agosto de 2014
- ↑ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (2011). Arcidiacono, Paolo G, ed. «Celiac plexus block for pancreatic cancer pain in adults». Cochrane Database Syst Rev (3): CD007519. PMID 21412903. doi:10.1002/14651858.CD007519.pub2
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomecancer.org - ↑ «Cancer Facts and Figures 2014» (PDF). American Cancer Society. Consultado em 5 de janeiro de 2015