Vírus da imunodeficiência humana: diferenças entre revisões
id. |
|||
| Linha 61: | Linha 61: | ||
| author=Feng Y, Broder CC, Kennedy PE, Berger EA | title=HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor | journal=Science | year=1996 | pages=872–7 | volume=272 | issue=5263 |pmid=8629022 | doi=10.1126/science.272.5263.872 |bibcode = 1996Sci...272..872F }}</ref> Pensa-se que as cadeias VIH-1 de tropismo duplo sejam cadeias de VIH-1 em transição, e portanto capazes de usar como co-recetores de entrada tanto o CCR5 como o CXCR4. A quimioquina-alfa SDF-1, um [[ligante]] do CXCR4, suprime a replicação dos tipos T-trópicos. Consegue-o através da infra-regulação da expressão do CXCR4 na superfície destas células. O VIH que usa apenas o co-recetor CCR5 é denominado R5; o que usa apenas o CXCR4 é denominado X4; e o que usa ambos é denominado X4R5. No entanto, o uso do co-recetor por si só não explica o tropismo viral, já que nem todos os vírus R5 são capazes de usar o CCR5 em macrófagos de modo a dar origem a uma infeção bem sucedida e o VIH pode também infetar um subtipo de [[Célula dendrítica|células dendríticas]] [[mieloide]]s, que provavelmente constituem uma reserva que mantém a infeção quando a contagem de células CD4<sup>+</sup> desce para níveis extremamente baixos.<ref name=Coakley /><ref name=Knight>{{cite journal |
| author=Feng Y, Broder CC, Kennedy PE, Berger EA | title=HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor | journal=Science | year=1996 | pages=872–7 | volume=272 | issue=5263 |pmid=8629022 | doi=10.1126/science.272.5263.872 |bibcode = 1996Sci...272..872F }}</ref> Pensa-se que as cadeias VIH-1 de tropismo duplo sejam cadeias de VIH-1 em transição, e portanto capazes de usar como co-recetores de entrada tanto o CCR5 como o CXCR4. A quimioquina-alfa SDF-1, um [[ligante]] do CXCR4, suprime a replicação dos tipos T-trópicos. Consegue-o através da infra-regulação da expressão do CXCR4 na superfície destas células. O VIH que usa apenas o co-recetor CCR5 é denominado R5; o que usa apenas o CXCR4 é denominado X4; e o que usa ambos é denominado X4R5. No entanto, o uso do co-recetor por si só não explica o tropismo viral, já que nem todos os vírus R5 são capazes de usar o CCR5 em macrófagos de modo a dar origem a uma infeção bem sucedida e o VIH pode também infetar um subtipo de [[Célula dendrítica|células dendríticas]] [[mieloide]]s, que provavelmente constituem uma reserva que mantém a infeção quando a contagem de células CD4<sup>+</sup> desce para níveis extremamente baixos.<ref name=Coakley /><ref name=Knight>{{cite journal |
||
| author=Knight SC, Macatonia SE, Patterson S | title=HIV I infection of dendritic cells | journal=[[International Review of Immunology]] | year=1990 | pages=163–75 | volume=6 | issue=2–3 | pmid=2152500 | doi=10.3109/08830189009056627 }}</ref> Algumas pessoas são resistentes a determinadas estirpes de VIH.Por exemplo, pessoas com a mutação [[CCR5#CCR5-Δ32|CCR5-Δ32]] são resistentes a infeções com o vírus R5, uma vez que a mutação impede o VIH de se ligar ao seu co-recetor, reduzindo a sua capacidade de infetar células-alvo.<ref name=Tang>{{cite journal |author=Tang J, Kaslow RA | title=The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy | journal=AIDS | year=2003 | pages=S51–S60 | volume=17 | issue=Suppl 4 | pmid=15080180 | doi=10.1097/00002030-200317004-00006}}</ref> |
| author=Knight SC, Macatonia SE, Patterson S | title=HIV I infection of dendritic cells | journal=[[International Review of Immunology]] | year=1990 | pages=163–75 | volume=6 | issue=2–3 | pmid=2152500 | doi=10.3109/08830189009056627 }}</ref> Algumas pessoas são resistentes a determinadas estirpes de VIH.Por exemplo, pessoas com a mutação [[CCR5#CCR5-Δ32|CCR5-Δ32]] são resistentes a infeções com o vírus R5, uma vez que a mutação impede o VIH de se ligar ao seu co-recetor, reduzindo a sua capacidade de infetar células-alvo.<ref name=Tang>{{cite journal |author=Tang J, Kaslow RA | title=The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy | journal=AIDS | year=2003 | pages=S51–S60 | volume=17 | issue=Suppl 4 | pmid=15080180 | doi=10.1097/00002030-200317004-00006}}</ref> |
||
A [[relação sexual]] é o principal meio de transmissão do VIH. Tanto o VIH X4 como o R5 estão presentes no [[sémen]] que é transmitido entre o homem e o seu parceiro sexual. Os viriões podem assim infetar vários alvos celulares e disseminar-se por todo o organismo. No entanto, a existência de um processo de seleção faz com que através desta via seja predominante a transmissão do vírus R5.<ref name=Zhu1993>{{cite journal | author=Zhu T, Mo H, Wang N, Nam DS, Cao Y, Koup RA, Ho DD | title=Genotypic and phenotypic characterization of HIV-1 patients with primary infection | journal=Science | year=1993 | pages=1179–81 | volume=261 | issue=5125 | pmid=8356453 | doi=10.1126/science.8356453|bibcode = 1993Sci...261.1179Z }}</ref><ref name=Wout>{{cite journal | author=van’t Wout AB, Kootstra NA, Mulder-Kampinga GA, Albrecht-van Lent N, Scherpbier HJ, Veenstra J, Boer K, Coutinho RA, Miedema F, Schuitemaker H. | title=Macrophage-tropic variants initiate human immunodeficiency virus type 1 infection after sexual, parenteral, and vertical transmission | journal=J Clin Invest | year=1994 | pages=2060–7 | volume=94 | issue=5 | pmid=7962552 | doi=10.1172/JCI117560 | pmc=294642 }}</ref><ref name=Zhu1996>{{cite journal | author=Zhu T, Wang N, Carr A, Nam DS, Moor-Jankowski R, Cooper DA, Ho DD | title=Genetic characterization of human immunodeficiency virus type 1 in blood and genital secretions: evidence for viral compartmentalization and selection during sexual transmission | journal=J Virol | year=1996 | pages=3098–107 | volume=70 | issue=5 | pmid=8627789 | pmc=190172 }}</ref> A forma como o processo seletivo funciona está ainda a ser investigada, mas um dos modelos propõe que os [[espermatozoide]]s possam seletivamente transportar VIH R5, uma vez que na superfície possuem CCR3 e CCR5, mas não CXCR4,<ref name=Muciaccia>{{cite journal| author=Muciaccia B, Padula F, Vicini E, Gandini L, Lenzi A, Stefanini M | title=Beta-chemokine receptors 5 and 3 are expressed on the head region of human spermatozoon | journal=FASEB J | year=2005 | pages=2048–50 | volume=19 | issue=14 | pmid=16174786 | doi=10.1096/fj.05-3962fje }}</ref> e que as [[epitélio|células epiteliais]] genitais sequestram de forma preferencial vírus X4.<ref name=Berlier>{{cite journal | author=Berlier W, Bourlet T, Lawrence P, Hamzeh H, Lambert C, Genin C, Verrier B, Dieu-Nosjean MC, Pozzetto B, Delezay O | title=Selective sequestration of X4 isolates by human genital epithelial cells: Implication for virus tropism selection process during sexual transmission of HIV | journal=J Med Virol. | year=2005 | pages=465–74 | volume=77 | issue=4 | pmid=16254974 | doi=10.1002/jmv.20478 }}</ref> Em pessoas infetadas com o subtipo HIV-1, muitas vezes verifica-se a troca de co-recetor durante a fase avançada da doença, e as variantes T-trópicas aparentam poder infetar diferentes linfócitos T através do CXCR4.<ref name=Clevestig>{{cite journal |author=Clevestig P, Maljkovic I, Casper C, Carlenor E, Lindgren S, Naver L, Bohlin AB, Fenyo EM, Leitner T, Ehrnst A | title=The X4 phenotype of HIV type 1 evolves from R5 in two children of mothers, carrying X4, and is not linked to transmission | journal=AIDS Res Hum Retroviruses | year=2005 | pages=371–8 | volume=5 | issue=21 | pmid=15929699 | doi=10.1089/aid.2005.21.371 }}</ref> Estas variantes replicam-se então de forma mais agressiva e com maior virulência, o que provoca a diminuição acentuada dos linfócitos T, o colapso do sistema imunitário e o aparecimento de infeções oportunistas, características da SIDA.<ref name=Moore>{{cite journal | author=Moore JP | title=Coreceptors: implications for HIV pathogenesis and therapy |journal=Science | year=1997 | pages=51–2 | volume=276 | issue=5309 | pmid=9122710 | doi=10.1126/science.276.5309.51 }}</ref> Assim, durante o curso da infeção, a adaptação viral para passar a usar o CXCR4 em vez do CCR5 pode representar um passo fundamental na progressão para a SIDA. Vários estudos em indivíduos infetados com o subtipo B concluíram que 40 a 50% dos pacientes com SIDA podem apresentar vírus T-trópicos e, presume-se, fenótipos X4.<ref name=Karlsson>{{cite journal | author=Karlsson A, Parsmyr K, Aperia K, Sandstrom E, Fenyo EM, Albert J.| title=MT-2 cell tropism of human immunodeficiency virus type 1 isolates as a marker for response to treatment and development of drug resistance | journal=J Infect Dis. | year=1994 | pages=1367–75 | volume=170 | issue=6 | pmid=7995974 | doi=10.1093/infdis/170.6.1367 }}</ref><ref name=Koot>{{cite journal |
|||
| author=Koot M, van 't Wout AB, Kootstra NA, de Goede RE, Tersmette M, Schuitemaker H.| title=Relation between changes in cellular load, evolution of viral phenotype, and the clonal composition of virus populations in the course of human immunodeficiency virus type 1 infection | journal=J Infect Dis. | year=1996 | pages=349–54 | volume=173 | issue=2 | pmid=8568295 | doi=10.1093/infdis/173.2.349 }}</ref> |
|||
O VIH-2 é muito menos patogénico do que o VIH-1 e a sua ocorrência é mais restrita em termos globais. A adoção de "genes acessórios" pelo VIH-2 e o seu padrão promíscuo de utilização de coreceptores (incluindo a independência relativamente ao CD4) pode auxiliar o vírus na sua adaptação de forma a evitar fatores de restrição inatos presentes nas células anfitriãs. A capacidade do VIH-2 em se replicar nos seres humanos pode ter origem na capacidade de adaptação do vírus, de modo a ser capaz de usar processos celulares normais de forma a permitir a transmissão e a infeção produtiva. Uma das estratégias de sobrevivência de qualquer agente infecioso é não matar o seu hospedeiro, mas antes estabelecer uma relação de [[comensalismo]] entre organismos. Tendo conseguido obter baixa petogenicidade, ao longo do tempo irão sendo selecionadas as variantes mais eficazes na transmissão.<ref name= CheneyandMcKnight>{{cite book |author= Cheney K, McKnight A |chapter=HIV-2 Tropism and Disease | year=2010 |title=Lentiviruses and Macrophages: Molecular and Cellular Interactions | publisher=Caister Academic Press | isbn=978-1-904455-60-8 }}</ref> |
|||
| ⚫ | |||
[[File:HIV gross cycle only.png|thumb|Ciclo de replicação do VIH]] |
|||
====Penetração celular==== |
|||
O VIH penetra nos [[macrófago]]s e nos [[Linfócito T|linfócitos T]] CD4<SUP>+</SUP> através da [[adsorção]] de [[glicoproteína]]s na sua superfície para recetores na célula-alvo, seguida pela fusão do [[envelope viral]] com a membrana celular e pela libertação do [[capsídeo]] do VIH na célula.<ref name=Chan2>{{cite journal |author=Chan D, Kim P |title=HIV entry and its inhibition |journal=Cell |volume=93 |issue=5 |pages=681–4 |year=1998 |pmid=9630213 |doi=10.1016/S0092-8674(00)81430-0}}</ref><ref name=Wyatt>{{cite journal |author=Wyatt R, Sodroski J |title=The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens |journal=Science |volume=280 |issue=5371 |pages=1884–8 |year=1998 | doi=10.1126/science.280.5371.1884 |pmid=9632381|bibcode = 1998Sci...280.1884W }}</ref> |
|||
A penetração na célula tem início com a interação do complexo envelope [[trímero]] ([[gp160]]) com o [[CD4]] e um recetor de quimiocina na superfície da célula (geralmente o [[CCR5]] ou [[CXCR4]], embora sejam conhecidos outros).<ref name=Chan2/><ref name=Wyatt/> A gp120 liga-se à [[integrina]] α<sub>4</sub>β<sub>7</sub>, ativando o [[LFA-1]], a principal integrina envolvida no estabelecimento de sinapses virológicas, que facilita a disseminação eficiente do VIH-1 entre células.<ref name=Arthos>{{cite journal |author=Arthos J, Cicala C, Martinelli E, Macleod K, Van Ryk D, Wei D, Xiao Z, Veenstra TD, Conrad TP, Lempicki RA, McLaughlin S, Pascuccio M, Gopaul R, McNally J, Cruz CC, Censoplano N, Chung E, Reitano KN, Kottilil S, Goode DJ, Fauci AS |title=HIV-1 envelope protein binds to and signals through integrin alpha(4)beta(7), the gut mucosal homing receptor for peripheral T cells |journal=Nature Immunology |volume=In Press |issue= 3|year=2008|pmid=18264102 |doi=10.1038/ni1566 |pages=301–9}}</ref> A gp160 contém domínios de ligação tanto para o CD4 como para os recetores de quimioquina.<ref name=Chan2/><ref name=Wyatt/> |
|||
O primeiro estágio na fusão envolve a união dos domínios de ligação CD4 da [[gp120]] ao CD4. Uma vez ligada a gp120 com a proteína CD4, o complexo envelope atravessa uma alteração na estrutura, expondo os domínios de ligação de quimioquina da gp120 e permitindo-lhes interagir com o recetor-alvo de quimioquina.<ref name=Chan2/><ref name=Wyatt/> Isto permite uma ligação mais estável, o que permite ao peptídeo de fusão N-terminal gp41 penetrar na membrana celular.<ref name=Chan2/><ref name=Wyatt/> Em seguida, as sequências de repetição na gp41, HR1 e HR2 interagem entre si, provocando o colapso da porção extracelular da gp41 num ''[[Hairpin loop|hairpin]]''. Esta estrutura circular aproxima o vírus da membrana celular, permitindo a fusão das suas membranas e consequente entrada do capsídeo viral.<ref name=Chan2/><ref name=Wyatt/> |
|||
Depois do VIH se ligar à célula-alvo, injeta nela o seu [[ARN]] e as suas diversas [[enzima]]s, incluindo a [[transcriptase reversa]], [[integrase]], [[ribonuclease]] e [[protease]].<ref name=Chan2/> O VIH pode infetar [[células dendríticas]] (CD) através do processo CD4-CCR5, embora possa também usar recetores de lectina tipo C.<ref name=Pope_2003>{{cite journal |author=Pope M, Haase A |title=Transmission, acute HIV-1 infection and the quest for strategies to prevent infection |journal=Nat Med |volume=9 |issue=7 |pages=847–52 |year=2003 |pmid=12835704 |doi=10.1038/nm0703-847}}</ref> As células dendríticas são uma das primeiras células que o vírus encontra durante a trensmissão por via sexual. Atualmente, pensa-se que as CD desempenhem um papel importante na transmissão do VIH para os linfócitos, durante o momento em que o vírus é capturado na [[mucosa]].<ref name=Pope_2003 /> Acredita-se que a presença da proteína FEZ-1, que ocorre naturalmente em [[neurónio]]s, impeça que o VIH infecte as células.<ref>{{cite doi|10.1073/pnas.0900502106|noedit}}</ref> |
|||
====Replicação e trasncrição==== |
|||
Pouco depois do capsídeo viral penetrar na célula, uma enzima denominada trenscriptase reversa liberta o genoma ARN de cadeia única das proteínas virais, e copia-o para uma [[ADN complementar|molécula complementar de ADN]].<ref name=Zheng>{{cite journal | author=Zheng YH, Lovsin N, Peterlin BM | title=Newly identified host factors modulate HIV replication | journal=Immunol. Lett. | year=2005 | pages=225–34 | volume=97 | issue=2 | pmid=15752562 | doi=10.1016/j.imlet.2004.11.026 }}</ref> O processo de transcrição reversa é extremamente predisposto a erros e as mutações daí resultantes podem provocar resistência aos anti-virais ou permitir ao vírus evadir o sistema imunitário. A transcriptase reversa tem também atividade de ribonuclease, que degrada o ARN viral durante a síntese de ADN complementar, assim como atividade de ADN polimerase ADN-dependente, capaz de criar ADN de [[Sentido (biologia molecular)|sentido positivo]] a partir do ADN complementar de sentido negativo.<ref>{{cite web |url=http://student.ccbcmd.edu/courses/bio141/lecguide/unit3/viruses/hivlc.html |work=Doc Kaiser's Microbiology Home Page |title=IV. VIRUSES - F. ANIMAL VIRUS LIFE CYCLES 3. The Life Cycle of HIV |publisher=Community College of Baltimore County |date=January 2008 }}</ref> Juntos, o ADN complementar e o seu complemento forma um ADN viral de cadeia dupla que é assim transportado para o [[núcleo celular]]. A integração do ADN viral com o genoma das células anfitriãs é realizada por outra enzima viral, denominada [[integrase]].<ref name=Zheng/> |
|||
[[File:Reverse Transcription.png|thumb|left|Transcrição reversa do genoma do VIH em ADN de cadeia dupla]] |
|||
O ADN viral, agora integrado na célula, pode permanecer dormente durante a fase latente da infeção.<ref name=Zheng/> De forma ao vírus poder ser produzido de forma ativa, têm que estar presentes determinados [[Fator de transcrição|fatores de transcrição]], o mais importante dos quais o [[NF-κB]] (factor nuclear kappa B), que é depois supra-regulado quando os linfócitos T são ativados.<ref name=Hiscott>{{cite journal | author=Hiscott J, Kwon H, Genin P | title=Hostile takeovers: viral appropriation of the NF-kB pathway | journal=J Clin Invest. | year=2001 | pages=143–151 | volume=107 | issue=2 | pmid=11160127 | doi=10.1172/JCI11918 |
|||
| pmc=199181 }}</ref> |
|||
Durante a replicação viral, o AND [[Provírus|proviral]] integrado é [[Transcrição (genética)|transcrito]] para [[ARN mensageiro|ARNm]], que é depois reorganizado através de ''[[splicing]]'' em partes mais pequenas. Estas partes são exportadas do núcleo para o [[citoplasma]], onde são transcritas para as [[proteínas reguladoras]] Tat (que incentiva a produção de novos vírus) e Rev. À medida que as proteínas Rev recém-formadas se acumulam no núcleo, vão-se ligando ao ARNm viral e permitem ao ARN que ainda não sofreu splicing abandonar o núcleo, onde de outra forma são retidos até sofrerem ''splicing''.<ref name=Pollard>{{cite journal | author=Pollard VW, Malim MH | title=The HIV-1 Rev protein | journal=Annu. Rev. Microbiol. | year=1998 | pages=491–532 | volume=52 | issue= | pmid=9891806 | doi=10.1146/annurev.micro.52.1.491 }}</ref> |
|||
====Recombinação==== |
|||
Em cada partícula de VIH-1 estão encapsidados dois genomas ARN. Durante a infeção e replicação catalisadas pela transcriptase reversa, pode ocorrer recombinação entre estes dois genomas.<ref name=Hu>Hu WS, Temin HM. (1990). Retroviral recombination and reverse transcription. Science 250(4985):1227-1233. PMID 1700865</ref><ref name=Charpentier>Charpentier C, Nora T, Tenaillon O, Clavel F, Hance AJ. (2006). Extensive recombination among human immunodeficiency virus type 1 quasispecies makes an important contribution to viral diversity in individual patients. J Virol 80(5):2472-2482. PMID 16474154 Free PMC Article</ref> A recombinação ocorre quando os genomas ARN+ de cadeia única são transcritos reversamente para formar ADN. Durante a trenscrição reversa o novo ADN pode alternar diversas vezes entre as duas cópias do ARN viral. Esta forma de recombinação é denominada cópia-escolha. Os processos de recombinação podem ocorrer ao longo de todo o genoma, e entre 2 e 20 eventos por genoma em cada ciclo de replicação. Estes eventos podem alterar rapidamente a informação genética que é transmitida dos genomas progenitores para os descendentes.<ref name=Charpentier /> |
|||
A recombinação viral produz variação genética que é provável que contribua para a evolução da resistência à terapia antiviral.<ref>Nora T, Charpentier C, Tenaillon O, Hoede C, Clavel F, Hance AJ. (2007). Contribution of recombination to the evolution of human immunodeficiency viruses expressing resistance to antiretroviral treatment. J Virol 81(14):7620-7628. PMID 17494080 Free PMC Article</ref> A recombinação pode também contribuir, em princípio, para vencer as defesas imunitárias do hospedeiro. No entanto, para que as vantagens adaptativas da variação genética ocorram, os dois genomas virais contidos em cada uma das partículas de vírus devem ter origem em diferentes vírus progenitores e de constituição genética distinta. Não se sabe ainda com que frequência este fenómeno ocorre em condições naturais.<ref>Chen J, Powell D, Hu WS. (2006). High frequency of genetic recombination is a common feature of primate lentivirus replication. J Virol 80(19):9651-9658. PMID 16973569 Free PMC Article</ref> |
|||
Um estudo sugeriu que a alternância do modelo por parte da transcriptase reversa atua como processo de reparação das quebras no genoma [[Vírus (+)ssRNA|ssARN]].<ref name=Bonhoeffer>Bonhoeffer S, Chappey C, Parkin NT, Whitcomb JM, Petropoulos CJ. (2004). Evidence for positive epistasis in HIV-1. Science 2004 306(5701):1547-1550. Erratum in: Science. 2008 May 9;320(5877):746. PMID 15567861 Free Article</ref> Outro estudo sugeriu que a recombinação é uma adaptação tendo em vista a reparação de danos nos genomas ARN.<ref name=Hu /> A variação na troca de fita pela transcriptase reversa poderia gerar uma cópia não danificada de ADN genómico a partir de duas cópias danificadas de genoma ssARN. Este ponto de vista dos benefícios da recombinação no VIH poderia explicar porque é que cada partícula de VIH contém dois genomas completos, em vez de apenas um. Além disso, no ponto de vista que sustenta que a recombinação no VIH é um processo de reparação está implícito que esse benefício possa ocorrer a cada ciclo de replicação, e que o benefício possa ser conseguido quer os genomas sejam ou não diferentes em termos genéticos.<ref name=Bonhoeffer /> |
|||
A infeção por VIH-1 provoca um processo inflamatório contínuo e a produção de [[Espécie reactiva de oxigénio|espécies reativas de oxigénio]].<ref>Israël N, Gougerot-Pocidalo MA. (1997). Oxidative stress in human immunodeficiency virus infection. Cell Mol Life Sci 53(11-12):864-870. PMID 9447238</ref> Assim, o genoma do VIH pode ser vulnerável a danos de oxidação, incluindo quebras no ARN de fita única. No caso do VIH, e para todos os vírus de forma genérica, a infeção bem sucedida está dependente de superar as estratégias defensivas do hospedeiro, que normalmente incluem a produção de oxigénio reativo capaz de destruir genoma. Um estudo sugeriu que a recombinação por parte dos vírus é uma adaptação com o objetivo de reparar os danos no genoma, e que a variação na recombinação é um subproduto que pode trazer benefícios acrescidos.<ref>Michod RE, Bernstein H, Nedelcu AM (2008). Adaptive value of sex in microbial pathogens. Infect Genet Evol 8(3):267-285. PMID 18295550 http://www.hummingbirds.arizona.edu/Faculty/Michod/Downloads/IGE%20review%20sex.pdf</ref> |
|||
====Montagem e lençamento==== |
|||
[[File:HIV on macrophage.png|thumb|right|Montagem do VIH na [[Membrana celular||superfície]] de um [[macrófago]] infetado.]] |
|||
O último passo do ciclo viral, a montagem dos viriões do novo VIH-1, tem início na membrana de plasma da célula anfitriã. A poliproteína Env (gp160) atravessa o [[retículo endoplasmático]] e é transportada para o [[complexo de Golgi]], onde é dividida pela [[furina]], dando origem às duas glicoproteínas do envelope do VIH, [[gp41]] e [[gp120]].<ref>{{cite journal |author=Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W |title=Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160 |journal=Nature|date=November 26, 1992 |volume=360|issue=6402 |pages=358–61 |pmid=1360148 |bibcode = 1992Natur.360..358H |doi = 10.1038/360358a0 }}</ref> Estas proteínas são transportadas para a [[membrana plasmática]] da célula anfitriã, na qual a gp41 fixa a gp120 à membrana da célula infetada. As poliproteínas Gag (p55) e Gag-Pol (p160) também interagem com a superfície interior da membrana plasmática, em conjunto com o ARN genómico do VIH, à medida que o virião em formação começa a despontar da célula anfitriã. Este novo virião encontra-se ainda imaturo, uma vez que as poliproteínas Gag precisam ainda de ser separadas em proteínas de matriz, capsídeo e nucleocapsídeo.Esta divisão é mediada pela [[protease]] viral e pode ser inibida por fármacos [[Antirretroviral|antirretrovirais]] da classe dos inibidores da protease. Finalmente, os vários componentes são montados de modo a produzir um virião de VIH amadurecido, que são os únicos capazs de infetar outras células.<ref name=Gelderblom>{{cite book | author= Gelderblom HR | year = 1997 | title = HIV sequence compendium | chapter = Fine structure of HIV and SIV |chapterurl=http://www.hiv.lanl.gov/content/sequence/HIV/COMPENDIUM/1997/partIII/Gelderblom.pdf | editor = Los Alamos National Laboratory | edition = | pages = 31–44 | publisher = [[Los Alamos National Laboratory]] }}</ref> |
|||
===Variabilidade genética==== |
|||
[[File:HIV-SIV-phylogenetic-tree.svg|thumb|left|[[Árvore filogenética]] do VIH e VIS.]] |
|||
O VIH difere de grande parte dos vírus na medida em que possui uma imensa [[variabilidade genética]]. Esta diversidade é resultado do seu rápido ciclo de replicação, capaz de gerar 10<sup>10</sup> viriões por dia; de uma elevada [[taxa de mutação]], de cerca de 3 x 10<sup>−5</sup> por [[nucleobase]] por ciclo de replicação; e das propriedades [[Recombinação genética|recombinativas]] da transcriptase reversa.<ref name=RobertsonDL>{{cite journal | author=Robertson DL, Hahn BH, Sharp PM. | title=Recombination in AIDS viruses | journal=J Mol Evol. | year=1995 | pages=249–59 | volume=40 | issue=3 | pmid=7723052 | doi=10.1007/BF00163230}}</ref><ref name="Rambaut_2004">{{cite journal | title=The causes and consequences of HIV evolution | journal=Nature Reviews Genetics | volume=5 | year=2004 | month=January | doi=10.1038/nrg1246 | pmid=14708016 | url=http://tree.bio.ed.ac.uk/downloadPaper.php?id=242 | issue=52–61 | last1=Rambaut |first1=A | last2=Posada | first2=D | last3=Crandall | first3=KA | last4=Holmes | first4=EC | pages=52–61}}</ref><ref name="pmid17960579">{{cite journal |author=Perelson AS, Ribeiro RM |title=Estimating drug efficacy and viral dynamic parameters: HIV and HCV |journal=Stat Med |volume=27 |issue=23 |pages=4647–57 |year=2008 |month=October |pmid=17960579 |doi=10.1002/sim.3116 |url=}}</ref> |
|||
Este esquema complexo leva a que sejam produzidas diversas variantes de VIH por dia num paciente infetado com VIH.<ref name=RobertsonDL/> Esta variabilidade é agravada quando uma célula é simultaneamente infetada por duas ou mais estirpes de VIH. Quando ocorre infeção em simultâneo, o genoma dos viriões progenitores pode ser constituído por fitas de ARN de duas estirpes diferentes. Este virião híbrido infeta depois uma nova célula, onde se replicará. Enquanto isto acontece, a transcriptase reversa, ao alternar entre dois padrões diferentes de ARN, vai gerar uma nova [[sequência de ADN]] retroviral que é uma recombinação entre os dois genomas progenitores.<ref name=RobertsonDL/> Esta recombinação é mais óbvia quando ocorrer entre subtipos.<ref name=RobertsonDL/> |
|||
O [[vírus da imunodeficiência símia]] (VIS) evoluiu para diversas estirpes, classificadas em função da espécie do hospedeiro natural. Pensa-se que as estirpes de VIS dos géneros ''[[Chlorocebus]]'' (VISagm) e ''[[Cercocebus atys]]'' (VISsmm) tenham tido uma longa história evolutiva em paralelo com os seus hospedeiros. Estes hospedeiros adaptaram-se à presença do vírus,<ref name=pmid19661993>{{Cite pmid|19661993}}</ref> que está presente em grande quantidade no seu sangue mas espoleta apenas uma resposta imune moderada,<ref>{{cite journal |author=Holzammer S, Holznagel E, Kaul A, Kurth R, Norley S |title=High virus loads in naturally and experimentally SIVagm-infected African green monkeys |journal=Virology |volume=283 |issue=2 |pages=324–31 |year=2001 |pmid=11336557 |doi=10.1006/viro.2001.0870}}</ref> não provoca o aparecimento da SIDA símia,<ref>{{Cite journal | author = Kurth, R. and Norley, S. | year = 1996 | title = Why don't the natural hosts of SIV develop simian AIDS? | url = | journal = J. NIH Res. | volume = 8 | issue = | pages = 33–37 }}</ref> e nem sofre as amplas mutações e recombinações típicas da infeção do VIH em seres humanos.<ref>{{cite journal |author=Baier M, Dittmar MT, Cichutek K, Kurth R |title=Development of vivo of genetic variability of simian immunodeficiency virus |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=88 |issue=18 |pages=8126–30 |year=1991 |pmid=1896460 |doi=10.1073/pnas.88.18.8126 |pmc=52459|bibcode = 1991PNAS...88.8126B }}</ref> |
|||
Em contraste, quando estas estirpes infetam espécies que não estão adaptadas ao VIS, os animais desenvolvem SIDA e o vírus gera [[diversidade genética]] semelhante à que é observada na infeção humana com o VIH..<ref>{{cite journal |author=Daniel MD, King NW, Letvin NL, Hunt RD, Sehgal PK, Desrosiers RC |title=A new type D retrovirus isolated from macaques with an immunodeficiency syndrome |journal=Science |volume=223 |issue=4636 |pages=602–5 |year=1984 |pmid=6695172 |doi=10.1126/science.6695172|bibcode = 1984Sci...223..602D }}</ref> O SIV em [[chimpanzé]]s (VIScpz), o parente genético mais próximo do VIH-1, está associado a maior mortalidade e sintomas semelhantes à SIDA no seu hospedeiro natural.<ref name=pmid19626114>{{Cite pmid|19626114}}</ref> O VIScpz aparenta ter sido transmitido aos chimpanzés e à população humana há relativamente pouco tempo, pelo que os seus hospedeiros não estão ainda adaptados ao vírus.<ref name=pmid19661993/> Este vírus também perdeu a função do gene Nef que está presente na maior parte dos VIS; sem esta função, é mais provável que ocorra a diminuição dos linfócitos T, levando à imunodeficiência.<ref name=pmid19626114/> |
|||
Foram identificados três grupos de VIH-1 com base nas diferenças entre a região do envelope (''env''): M, N e O.<ref name=Thomson>{{cite journal | author=Thomson MM, Perez-Alvarez L, Najera R | title=Molecular epidemiology of HIV-1 genetic forms and its significance for vaccine development and therapy | journal=Lancet Infectious Diseases | year=2002 | pages=461–471 | volume=2 | issue=8 | pmid=12150845 | doi=10.1016/S1473-3099(02)00343-2 }}</ref> O grupo M é o mais prevalente e é subdividido em oito subtipos (ou [[clado]]s) com base no genoma completo, que são distintos em termos geográficos.<ref name=Carr>{{cite book |
|||
| author = Carr JK, Foley BT, Leitner T, Salminen M, Korber B, McCutchan F | year = 1998 | title = HIV sequence compendium | chapter = Reference sequences representing the principal genetic diversity of HIV-1 in the pandemic | chapterurl = http://www.hiv.lanl.gov/content/sequence/HIV/COMPENDIUM/1998/III/Carr.pdf | editor = Los Alamos National Laboratory (ed.) | edition = | pages = 10–19 | publisher = [[Los Alamos National Laboratory]] | location = [[Los Alamos, New Mexico]] | format=PDF}}</ref> Os mais prevalentes são os subtipos B (encontrados principalmente na Europa e América do Norte), A e D (encontrados principalmente em África), e C (encontrado principalmente em África e na Ásia). Estes subtipos formam ramos na árvore filogénica que representam a linhagem do grupo M do VIH-1. A co-infeção com diferentes subtipos suscita formas recombinantes circulantes (FRC ou, em inglês, CRF). Em 2000, o último ano em que foi feita uma análise da prevalência à escala global dos subtipos, 47,2% das infeções eram do subtipo C, 26,7% eram do subtipo A/CRF02_AG, 12,3% eram do subtipo B, 5,3% do subtipo D, 3,2% eram CRF_AE, e os restantes 5,3% eram constituídos por outros subtipos e formas recombinantes.<ref name=Osmanov>{{cite journal | author=Osmanov S, Pattou C, Walker N, Schwardlander B, Esparza J; WHO-UNAIDS Network for HIV Isolation and Characterization | title=Estimated global distribution and regional spread of HIV-1 genetic subtypes in the year 2000 | journal=Acquired Immune Deficiency Syndrome | year=2002 | pages=184–190 | volume=29 | issue=2 | pmid=11832690 }}</ref> Grande parte da investigação relativa ao VIH-1 está focada no subtipo B e poucos laboratórios se focam nos restantes subtipos.<ref name=Perrin>{{cite journal | author=Perrin L, Kaiser L, Yerly S. | title=Travel and the spread of HIV-1 genetic variants | journal=Lancet Infect Dis. | year=2003 | pages=22–27 | volume=3 | issue=1 | pmid=12505029 | doi=10.1016/S1473-3099(03)00484-5 }}</ref> Tem sido colocada a hipótese de um outro grupo "P", com base num vírus isolado em 2009. A estirpe aparenta ser derivada do VIS do [[gorila]] (VISgor), isolada pela primeira vez em 2006.<ref name="Plantier_2009">{{cite journal |author=Plantier JC, Leoz M, Dickerson JE, et al. |title=A new human immunodeficiency virus derived from gorillas |journal=Nature Medicine |volume=15 |issue=8 |pages=871–2 |year=2009 |month=August |pmid=19648927 |doi=10.1038/nm.2016 |laysummary=http://www.independent.co.uk/life-style/health-and-families/health-news/woman-found-carrying-new-strain-of-hiv-from-gorillas-1766627.html }}</ref> |
|||
==Diagnóstico== |
|||
{{AP|Exame de HIV}} |
|||
[[File:Hiv-timecourse copy.svg|300px|thumb|right|Gráfico da relação entre as cópias do HIV (carga viral) e a contagem de CD4 ao longo do curso médio de uma infeção não tratada de VIH. {{legend-line|blue solid 2px|COntagem de linfócitos T CD4<sup>+</sup> T (nº de células por µL)}} {{legend-line|red solid 2px|Cópias de ARN do VIH por mL de plasma}}]] |
|||
Muitos seropositivos desconhecem que estão infetados com o vírus. Por exemplo, em 2001, menos de 1% da população urbana sexualmente ativa em África tinha sido testada, sendo esta percentagem ainda menor entre a população rural. No mesmo ano, só 0,5% das [[Gravidez|mulheres grávidas]] que tiveram uma consulta em áreas urbanas foram aconselhadas, examinadas ou receberam os resultados dos testes e, igualmente, esta percentagem é inferior em áreas rurais.<ref name=Kumaranayake>{{cite journal| author=Kumaranayake L, Watts C | title=Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa | journal=Journal of International Development | year=2001 | pages=451–466 | volume=13 | issue=4 | doi=10.1002/jid.797 }}</ref> Uma vez que os [[Doação de sangue|dadores de sangue]] podem não estar conscientes da sua infeção, o sangue doado é sistematicamente examinado em relação à presença de VIH.<ref name=Kleinman>{{cite web | author=Kleinman S | publisher=Uptodate | month=September | year=2004 | url=http://www.uptodate.com/patients/content/topic.do?topicKey=blod_dis/2419 | title=Patient information: Blood donation and transfusion | archiveurl=http://web.archive.org/web/20080412115832/http://www.uptodate.com/patients/content/topic.do?topicKey=blod_dis/2419 | archivedate=April 12, 2008}}</ref> |
|||
O teste de VIH-1 é inicialmente feito através de um exame [[ELISA]], que deteta a presença de anticorpos do VIH-1. Indivíduos com resultado não reativo ao primeiro exame são considerados seronegativos, até que se verifique nova exposição a um parceiro infetado. Indivíduos com resultado positivo são novamente testados.<ref name=CDC2001>{{cite journal | author=[[Centers for Disease Control and Prevention]] | title=Revised guidelines for HIV counseling, testing, and referral | journal=MMWR Recomm Rep | year=2001 | pages=1–57 | volume=50 | issue=RR–19 | pmid=11718472 }}</ref> Se o resultado de ambos os testes é reativo, o indivíduo é classificado como duplamente reativo e submetido e exames de confirmação com testes complementares mais específicos (por exemplo, ''[[western blot]]'' ou, menos comum, [[imunofluorescência]]. Apenas os indivíduos que são duplamente reativos pelo ELISA e positivos por imunofluorescência ou reativos pelo ''western blot'' é que são considerados seropositivos e indicadores da presença de uma infeção com o VIH. Alguns indivíduos que são duplamente reativos ao ELISA, ocasionalmente têm resultados indeterminados com ''western blot'', o que pode significar tanto uma resposta incompleta dos anticorpos ao VIH numa pessoa infetada, como reações não-específicas numa pessoa não infetada.<ref name=celum>{{cite journal| author=Celum CL, Coombs RW, Lafferty W, Inui TS, Louie PH, Gates CA, McCreedy BJ, Egan R, Grove T, Alexander S, et al. | title=Indeterminate human immunodeficiency virus type 1 western blots: seroconversion risk, specificity of supplemental tests, and an algorithm for evaluation | journal=J Infect Dis | year=1991 | pages=656–664 | volume=164 | issue=4 | pmid=1894929| doi=10.1093/infdis/164.4.656 }}</ref> Embora a imunofluorescência possa ser usada para confirmar a infeção nestes casos ambíguos, este ensaio não é amplamente usado. Regra geral, deve ser colhida uma segunda amostra mais de um mês depois da primeira, e novamente testadas as pessoas com resultados indeterminados de ''western blot''. Embora seja muito menos comum, o exame com [[ácido nucleico]] pode auxiliar o diagnóstico em determinadas situações.<ref name=CDC2001 /> |
|||
Os exames de VIH modernos são extremamente precisos. Um único exame apresenta resultados corretos em mais de 99% dos casos.<ref name=ScreenReview2005>{{cite journal |author=Chou R, Huffman LH, Fu R, Smits AK, Korthuis PT |title=Screening for HIV: a review of the evidence for the U.S. Preventive Services Task Force |journal=[[Annals of Internal Medicine]] |volume=143 |issue=1 |pages=55–73 |year=2005 |month=July |pmid=15998755 |doi= |url=http://www.annals.org/article.aspx?volume=143&page=55 }}</ref> Estima-se que a probabilidade da ocorrência de um resultado falso positivo no exame protocolar seja de apenas 1 em {{formatnum:250000}}, numa população de baixo risco.<ref name=ScreenReview2005/> É recomendado que, após uma exposição ao VIH, os exames sejam feitos de imediato, a seis semanas, a três meses e a seis meses.<ref name=PEP10>{{cite journal |author=Tolle MA, Schwarzwald HL |title=Postexposure prophylaxis against human immunodeficiency virus |journal=[[American Family Physician]] |date=July 15, 2010 |volume=82 |issue=2 |pages=161–6 |pmid=20642270}}</ref> |
|||
== História == |
== História == |
||
| Linha 249: | Linha 321: | ||
** '''tat'''. Um porção da estrutura do RNA do HIV é uma estrutura como um grampo de cabelo que inicialmente impede que uma [[transcrição]] completa ocorra. Parte do RNA é transcrita (ie. antes da parte do grampo) e codifica a proteína tat. A tat liga-se à CdK9/CycT e a fosforila, ajudando a alterar sua forma e a eliminar o efeito da estrutura de grampo do RNA. Isso por si só aumenta a taxa de transcrição, fornecendo um ciclo de [[retroalimentação]] positiva. Isto permite que o HIV tenha uma resposta explosiva, uma vez que uma grande quantidade de tat é produzida. |
** '''tat'''. Um porção da estrutura do RNA do HIV é uma estrutura como um grampo de cabelo que inicialmente impede que uma [[transcrição]] completa ocorra. Parte do RNA é transcrita (ie. antes da parte do grampo) e codifica a proteína tat. A tat liga-se à CdK9/CycT e a fosforila, ajudando a alterar sua forma e a eliminar o efeito da estrutura de grampo do RNA. Isso por si só aumenta a taxa de transcrição, fornecendo um ciclo de [[retroalimentação]] positiva. Isto permite que o HIV tenha uma resposta explosiva, uma vez que uma grande quantidade de tat é produzida. |
||
** '''rev'''. A rev permite que fragmentos do [[mRNA]] do HIV que contém uma unidade de resposta a rev (RRE) sejam exportados do [[núcleo celular|núcleo]] ao [[citoplasma]]. Na ausência da rev, a maquinaria de ''[[splicing]]'' do RNA no núcleo rapidamente cliva o RNA. Na presença da rev, o RNA é exportado do núcleo antes de ser clivado, num mecanismo de retroalimentação positiva. |
** '''rev'''. A rev permite que fragmentos do [[mRNA]] do HIV que contém uma unidade de resposta a rev (RRE) sejam exportados do [[núcleo celular|núcleo]] ao [[citoplasma]]. Na ausência da rev, a maquinaria de ''[[splicing]]'' do RNA no núcleo rapidamente cliva o RNA. Na presença da rev, o RNA é exportado do núcleo antes de ser clivado, num mecanismo de retroalimentação positiva. |
||
== O HIV e a resposta imune == |
|||
[[Ficheiro:Hiv timecourse (pt).png|thumb|500px|Nas primeiras semanas a quantidade viral aumenta imensamente, chegando a 1.000.000 de cópias/ml plasma, a fase aguda, quando contamina os órgãos linfáticos tornando a doença incurável. Depois o número de cópias diminui para alguns milhares por mililitro de plasma e leva anos para subir a níveis sintomáticos novamente. Enquanto isso, o número de linfócitos CD4+ diminui gradualmente.]] |
|||
A infecção começa com uma fase de viremia aguda, seguida por um período de latência clínica. Primeiramente, acreditava-se ser uma verdadeira latência viral como resultado da inserção do HIV no genoma hospedeiro em um estado não produtivo, aguardando condições favoráveis à transcrição. Houve, subsequentemente, um grande trabalho de pesquisa sobre os fatores de transcrição do HIV. Infelizmente, até por volta de 1993, a sensibilidade dos ensaios virais era precária. O uso das técnicas de amplificação por [[PCR]] a partir de 1993 permitiu detectar contagens virais de até 50 cópias/ml. |
|||
Foram detectadas células dendríticas infectadas com vírions, mostrando que a tão chamada fase de latência não implica inatividade do vírus. |
|||
== Centros de Testagem e Aconselhamento no Brasil == |
== Centros de Testagem e Aconselhamento no Brasil == |
||
| Linha 269: | Linha 334: | ||
É possível encontrar o CTA mais próximo da sua moradia no site do Fique Sabendo: [http://www.aids.gov.br/fiquesabendo/index.php?q=node/14]. |
É possível encontrar o CTA mais próximo da sua moradia no site do Fique Sabendo: [http://www.aids.gov.br/fiquesabendo/index.php?q=node/14]. |
||
=== Teste rápido === |
|||
Desde 2010 a Fiocruz produz o kit de teste rápido usando os fluídos da boca para identificar resposta do organismo ao HIV entre 20 a 30 minutos. O teste tradicional demora cerca de um mês e um grande número de pacientes não retorna para buscar o resultado. Esse novo teste Confirmatório Imunoblot Rápido, possui uma margem mínima de erro e custa cinco vezes menos ao governo federal que o modelo rápido anterior. Já está disponível em alguns hospitais públicos desde 2011. Uma das principais vantagens é não precisar expor mãe grávida e feto aos antirretrovirais preventivamente enquanto o resultado não fica pronto como podia ser necessário no tradicional.<ref>http://www.estadao.com.br/noticias/vidae,fiocruz-lanca-teste-rapido-para-diagnostico-de-hiv-em-25-minutos,648153,0.htm</ref> |
|||
Algumas cidades em Pernambuco, Bahia e Rondônia fizeram um projeto para aplicar o teste rápido em centenas de pessoas após o carnaval. <ref>http://www.correio24horas.com.br/noticias/detalhes/detalhes-1/artigo/840-pessoas-realizaram-teste-rapido-para-hiv-no-carnaval/</ref><ref>http://www.rondoniagora.com/noticias/prefeitura-disponibiliza-teste-rapido-para-periodo-pos-carnaval-2011-03-10.htm</ref> <ref>http://jc.uol.com.br/canal/cotidiano/saude/noticia/2011/03/12/saude-convida-foliao-para-fazer-teste-de-aids-260849.php</ref> |
|||
== Tratamento == |
== Tratamento == |
||
| Linha 347: | Linha 406: | ||
* ''Assim que a pessoa descobrir que é portador ela deve começar o tratamento'' - Apenas caso os sintomas da AIDS já tenham aparecido. Mas caso feitos antes dos sintomas podem demorar anos antes de começar o tratamento. O tratamento só começa quando a imunidade está seriamente comprometida. Existem alguns casos de pacientes que foram contaminados há mais de 12 anos e ainda não precisaram tomar o antirretroviral mas geralmente leva de 4 a 7 anos desde a infecção inicial. |
* ''Assim que a pessoa descobrir que é portador ela deve começar o tratamento'' - Apenas caso os sintomas da AIDS já tenham aparecido. Mas caso feitos antes dos sintomas podem demorar anos antes de começar o tratamento. O tratamento só começa quando a imunidade está seriamente comprometida. Existem alguns casos de pacientes que foram contaminados há mais de 12 anos e ainda não precisaram tomar o antirretroviral mas geralmente leva de 4 a 7 anos desde a infecção inicial. |
||
| ⚫ | |||
[[Imagem:Virus infecting lymphocytes.gif|thumb|O HIV usa a membrana da própria célula para se proteger enquanto se locomove para outra célula]] |
|||
O '''HIV''' entra no [[linfócito]] auxiliar(Helper) T CD4+ ao ligar-se à molécula ''CXCR4'' ou às moléculas ''CXCR4'' e ''CCR5'', dependendo do estágio no qual a infecção pelo HIV se encontra. Uma proteína cofator (fusina) é requerida para auxiliar na ligação do vírus à membrana da célula T. Durante as fases iniciais de uma típica infecção pelo HIV, as duas moléculas ''CCR5'' e ''CXCR4'' estão ligadas, enquanto que um estágio mais avançado da infecção geralmente envolve mutações do HIV que apenas ligam-se à molécula ''CXCR4''. |
|||
Uma vez que o HIV está ligado ao linfócito T CD4+, uma estrutura viral conhecida como ''GP41'' penetra na membrana celular e o [[RNA]] do HIV e várias [[enzima]]s, incluindo (mas não limitada) à transcriptase reversa, integrase e protease são injetadas na célula. |
|||
Uma vez que a célula T hospedeira não processa o RNA em proteínas, o próximo passo é gerar um DNA a partir do RNA do HIV usando a enzima transcritase reversa para que ocorra a transcripção reversa. Se bem sucedida, o DNA pró-viral deve ser então integrado ao DNA da célula hospedeira usando a enzima integrase. Se o DNA pró-viral é integrado ao DNA da célula hospedeira, a célula torna-se altamente infectada, mas não produzindo ativamente proteínas do HIV. Esse é o [[latência|estágio latente]] do HIV, uma infecção durante a qual a célula infectada pode ser uma "bomba não explodida" potencialmente por um longo tempo. |
|||
O vírus pode ficar escondido na médula óssea, onde fica protegido do efeito de medicamentos e dormente, conforme estudo publicado na revista ''[[Nature]] Medicine''. Descobrir onde o vírus latente se esconde é o primeiro passo para eliminá-lo <ref>[http://www.estadao.com.br/estadaodehoje/20100308/not_imp520907,0.php Estudo acha esconderijo do HIV] - ''[[O Estado de S.Paulo]]'', 8 de março de 2010 (visitado em 8-3-2010)</ref>. |
|||
== {{Ver também}} == |
== {{Ver também}} == |
||
Revisão das 20h09min de 18 de outubro de 2013
| Vírus da imunodeficiência humana | |||||||
|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||
| |||||||
| Espécies | |||||||
| |||||||
O Vírus da Imunodeficiência Humana (VIH) é um lentivirus (um retrovirus com um longo período de incubação) que está na origem da Síndrome da Imunodeficiência Adquirida,[1][2] uma condição em seres humanos na qual a deterioração progressiva do sistema imunitário propicia o desenvolvimento de infeções oportunistas e cancros potencialmente mortais. A infeção com o VIH tem origem na transferência de sangue, sémen, lubrificação vaginal, fluido pré-ejaculatório ou leite materno. O VIH está presente nestes fluidos corporais, tanto na forma de partículas livres como em células imuntárias infectadas.
O VIH infecta células vitais no sistema imunitário, como os linfócitos T auxiliares, macrófagos e células dendríticas.[3] A infeção por HIV provoca níveis reduzidos linfócitos T CD4+ através de diversos mecanismos, entre os quais a apoptose de células espectadoras,[4] a morte viral direta de células infectadas, e morte de linfócitos T CD4+ através de linfócitos T citotóxicos CD8 que reconhecem as células infetadas.[5] Quando os linfócitos T CD4+ descem abaixo do limiar aceitável, o corpo perde a imunidade mediada por células e torna-se progressivamente mais suscetível a infeções oportunistas.
Virologia
Classificação
| Espécie | Virulência | Infectividade | Prevalência | Origem deduzida |
|---|---|---|---|---|
| VIH-1 | Elevada | Elevada | Global | Chimpanzé-comum |
| VIH-2 | Muito baixa | Baixa | África Ocidental | Cercocebus atys |
O VIH é um membro do género Lentivirus,[6] e parte da família Retroviridae.[7] Os lentivirus têm diversas propriedades morfológicas e biológicas em comum. Muitas espécies são infectadas por lentivírus, que são caracteristicamente responsáveis por doenças de longa duração com período de incubação longo.[8] Os lentivírus são transmitidos como vírus ARN encapsulados, de sentido positivo e de cadeia única. Ao entrar na célula-alvo, o genoma ARN viral é convertido em ADN de cadeia dupla pela transcriptase reversa, que é transportada juntamente com o genoma viral na partícula do vírus. O ADN viral resultante é então importado para o núcleo celular e integrado no ADN celular pela integrase e cofactores. Uma vez integrado, o vírus pode tornar-se latente, peritindo-lhe a si e à célula hospedeira não serem detectados pelo sistema imunitário. Em elternativa, o vírus pode ser transcrito, produzindo novos genomas ARN e proteínas virais que são libertadas das células como novas partículas virais que iniciam novamente o ciclo de reprodução.[9]
Foram identificados dois tipos de VIH: o VIH-1 e o VIH-2. O VIH-1 é o vírus que foi inicialmente descoberto e denominado LAV e HTLV-III. É o mais virulento, mais infeccioso,[10] e o que provoca a maioria das infeções por VIH a nível mundial. A menor infecciosidade do VIH-2 em comparação com o VIH-1 indica que, a cada exposição, o risco de contágio é menor. Devido à sua reduzida capacidade de contágio, o VIH-2 está maioritariamente restrito à África Ocidental.[11]
Estrutura e genoma

A estrutura do VIH é diferente da de outros retrovírus. É aproximadamente esférica e com um diâmetro de cerca de 120 nm, cerca de 60 vezes menor que um glóbulo vermelho, ainda que grande para um vírus.[12][13] É composto por duas cópias de ARN positivo de cadeia única que codifica os nove genes do vírus, envolto por um capsídeo cónico composto de 2000 cópias da proteína viral p24.[14] O ARN de cadeia único está intimamente ligado às proteínas da nucleocapside, p7, e às enzimas necessárias ao desenvolvimento do virião como a Transcriptase reversa, a aspartate protease, ribonuclease e integrase. O capsídeo é envolto por uma matriz composta pela proteína viral p17, assegurando a integridade da partícula do virião.[14]
Este conjunto é por sua vez envolto pelo envelope viral, que é composto por duas camadas de moléculas gordas denominadas fosfolípidos, obtidas a partir da membrana de uma célula humana quando uma partícula viral recém-formada brota da célula. No enveleope viral estão incorporadas proteínas da célula anfitriã e cerca de 70 cópias de uma proteína complexa do VIH que é proeminente na superfície da partícula viral.[14] Esta proteína, conhecida por Env, consiste num conjunto de três moléculas denominadas glicoproteína (gp) 120, e uma haste que consiste em três moléculas gp41 que ligam a estrutura ao envelope viral.[15] Este complexo glicoproteico permite ao vírus ligar-se e fundir-se com as células-alvo de modo a dar início ao ciclo de infeção.[15] Estas duas proteínas de superfície, sobretudo a gp120, têm vindo a ser identificadas como o alvo de futuros tratamentos ou vacinas contra o VIH.[16]
O genoma de ARN consiste em pelo menos sete marcos estruturais (LTR, TAR, RRE, PE, SLIP, CRS e INS) e nove genes ('gag, pol, and env, tat, rev, nef, vif, vpr, vpu, e por vezes um décimo tev, que consiste numa fusão de tat, env e rev), codificando 19 proteínas. Três destes genes, gag, pol e env, contêm a informação necessária para produzir as proteínas estruturais de novas partículas virais.[14] por exemplo, o env codifica uma proteína denominada gp160 que é quebrada por uma protease celular de modo a formar gp120 e gp41. Os restantes seis genes, 'tat, rev, nef, vif, vpr, e vpu (ou vpx no caso do VIH-2), são genes reguladores para proteínas que controlam a capacidade do VIH em infectar céulas, produzir novas cópias de si mesmo (replicar-se) ou provoca a doença.[14]
As duas proteínas Tat (p16 e p14) são trans-ativadores transcricionais do LTR, atuando ao ligar o elemento ARN do TAR. O TAR pode também ser processado em micro-ARNs que regulam os genes da apoptose ERCC1 e IER3.[17][18] A proteína Rev (p19) está envolvida no encerramento dos ARN do núcleo e do citoplasma, ao ligar-se ao elemento de ARN RRE. A proteína Vif (p23) previne a acção da APOBEC3G (uma proteína celular que devide os híbridos de ADN:ARN e/ou interfere com a proteína Pol). A proteína Vpr (p14) pára a divisão celular e G2/M. A proteína Nef (p27) infra-regula o CD4 (o maior recetor viral), assim como as moléculas MHC classe I e II.[19][20][21] A proteína Vpu (p16) influencia a libertação de novas partículas virais a partir de células infectadas.[14] As extremidades de cada cadeia de ARN do HIV contêm uma sequência de ARN denominada long terminal repeat (LTR). As regiões no LTR atuam como interruptores que controlam a produção de novos vírus e podem ser ativadas pelas proteínas quer do VIH quer da caélula anfitriã. O elemento Psi está envolvido no envelope do genoma viral e é reconhecido pelas proteínas Gag e Rev. O elemento SLIP está envolvido no deslocamento do quadro de leitura Gag-Pol, necessário para a produção de Pol funcional.[14]
Tropismo

O termo tropismo viral refere-se ao tipo de células que determinado vírus infeta. O VIH pode infetar diversas células imunitárias, como os linfócitos T CD4+, macrófagos e microgliócitos. A entrada do VIH-1 nos macrófagos e nos linfócitos CD4+ é mediada através da interação das glicoproteínas do envelope do virião (gp120) com a molécula CD4 nas células-alvo, e ainda através de co-recetores de quimiocina.[15]
As cadeias do VIH-1 que afectam os macrófagos (M-trópicas) usam os co-recetores de quimiocina CCR5 para entrar, sendo assim capazes de se replicarem em macrófagos e linfócitos T CD4+.[22] Este co-recetor CCR5 é usado por praticamente todos os tipos primários de VIH-1, independentemente do seu subtipo genético. Assim, os macrófagos desempenham um papel essencial em vários aspetos fundamentais da infeção por VIH, aparentando ser as primeiras células a ser infetadas e talvez a fonte de produção de VIH a partir do momento em que o doente perde as células CD4. Em amígdalas e adenoides de doentes infetados com VIH, os macrófagos fundem-se em células de grandes dimensões e vários núcleos que produzem grandes quantidades de partículas virais. As cadeias T-trópicas replicam-se tanto em linfócitos T CD4+ como em macrófagos e usam para entrar o co-recetor de quimioquina CXCR4.[22][23][24] Pensa-se que as cadeias VIH-1 de tropismo duplo sejam cadeias de VIH-1 em transição, e portanto capazes de usar como co-recetores de entrada tanto o CCR5 como o CXCR4. A quimioquina-alfa SDF-1, um ligante do CXCR4, suprime a replicação dos tipos T-trópicos. Consegue-o através da infra-regulação da expressão do CXCR4 na superfície destas células. O VIH que usa apenas o co-recetor CCR5 é denominado R5; o que usa apenas o CXCR4 é denominado X4; e o que usa ambos é denominado X4R5. No entanto, o uso do co-recetor por si só não explica o tropismo viral, já que nem todos os vírus R5 são capazes de usar o CCR5 em macrófagos de modo a dar origem a uma infeção bem sucedida e o VIH pode também infetar um subtipo de células dendríticas mieloides, que provavelmente constituem uma reserva que mantém a infeção quando a contagem de células CD4+ desce para níveis extremamente baixos.[22][25] Algumas pessoas são resistentes a determinadas estirpes de VIH.Por exemplo, pessoas com a mutação CCR5-Δ32 são resistentes a infeções com o vírus R5, uma vez que a mutação impede o VIH de se ligar ao seu co-recetor, reduzindo a sua capacidade de infetar células-alvo.[26]
A relação sexual é o principal meio de transmissão do VIH. Tanto o VIH X4 como o R5 estão presentes no sémen que é transmitido entre o homem e o seu parceiro sexual. Os viriões podem assim infetar vários alvos celulares e disseminar-se por todo o organismo. No entanto, a existência de um processo de seleção faz com que através desta via seja predominante a transmissão do vírus R5.[27][28][29] A forma como o processo seletivo funciona está ainda a ser investigada, mas um dos modelos propõe que os espermatozoides possam seletivamente transportar VIH R5, uma vez que na superfície possuem CCR3 e CCR5, mas não CXCR4,[30] e que as células epiteliais genitais sequestram de forma preferencial vírus X4.[31] Em pessoas infetadas com o subtipo HIV-1, muitas vezes verifica-se a troca de co-recetor durante a fase avançada da doença, e as variantes T-trópicas aparentam poder infetar diferentes linfócitos T através do CXCR4.[32] Estas variantes replicam-se então de forma mais agressiva e com maior virulência, o que provoca a diminuição acentuada dos linfócitos T, o colapso do sistema imunitário e o aparecimento de infeções oportunistas, características da SIDA.[33] Assim, durante o curso da infeção, a adaptação viral para passar a usar o CXCR4 em vez do CCR5 pode representar um passo fundamental na progressão para a SIDA. Vários estudos em indivíduos infetados com o subtipo B concluíram que 40 a 50% dos pacientes com SIDA podem apresentar vírus T-trópicos e, presume-se, fenótipos X4.[34][35]
O VIH-2 é muito menos patogénico do que o VIH-1 e a sua ocorrência é mais restrita em termos globais. A adoção de "genes acessórios" pelo VIH-2 e o seu padrão promíscuo de utilização de coreceptores (incluindo a independência relativamente ao CD4) pode auxiliar o vírus na sua adaptação de forma a evitar fatores de restrição inatos presentes nas células anfitriãs. A capacidade do VIH-2 em se replicar nos seres humanos pode ter origem na capacidade de adaptação do vírus, de modo a ser capaz de usar processos celulares normais de forma a permitir a transmissão e a infeção produtiva. Uma das estratégias de sobrevivência de qualquer agente infecioso é não matar o seu hospedeiro, mas antes estabelecer uma relação de comensalismo entre organismos. Tendo conseguido obter baixa petogenicidade, ao longo do tempo irão sendo selecionadas as variantes mais eficazes na transmissão.[36]
Ciclo de replicação
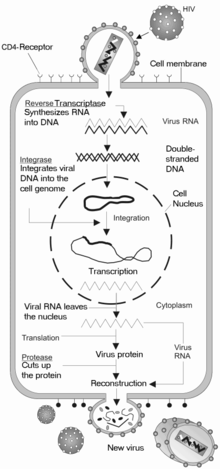
Penetração celular
O VIH penetra nos macrófagos e nos linfócitos T CD4+ através da adsorção de glicoproteínas na sua superfície para recetores na célula-alvo, seguida pela fusão do envelope viral com a membrana celular e pela libertação do capsídeo do VIH na célula.[37][38]
A penetração na célula tem início com a interação do complexo envelope trímero (gp160) com o CD4 e um recetor de quimiocina na superfície da célula (geralmente o CCR5 ou CXCR4, embora sejam conhecidos outros).[37][38] A gp120 liga-se à integrina α4β7, ativando o LFA-1, a principal integrina envolvida no estabelecimento de sinapses virológicas, que facilita a disseminação eficiente do VIH-1 entre células.[39] A gp160 contém domínios de ligação tanto para o CD4 como para os recetores de quimioquina.[37][38]
O primeiro estágio na fusão envolve a união dos domínios de ligação CD4 da gp120 ao CD4. Uma vez ligada a gp120 com a proteína CD4, o complexo envelope atravessa uma alteração na estrutura, expondo os domínios de ligação de quimioquina da gp120 e permitindo-lhes interagir com o recetor-alvo de quimioquina.[37][38] Isto permite uma ligação mais estável, o que permite ao peptídeo de fusão N-terminal gp41 penetrar na membrana celular.[37][38] Em seguida, as sequências de repetição na gp41, HR1 e HR2 interagem entre si, provocando o colapso da porção extracelular da gp41 num hairpin. Esta estrutura circular aproxima o vírus da membrana celular, permitindo a fusão das suas membranas e consequente entrada do capsídeo viral.[37][38]
Depois do VIH se ligar à célula-alvo, injeta nela o seu ARN e as suas diversas enzimas, incluindo a transcriptase reversa, integrase, ribonuclease e protease.[37] O VIH pode infetar células dendríticas (CD) através do processo CD4-CCR5, embora possa também usar recetores de lectina tipo C.[40] As células dendríticas são uma das primeiras células que o vírus encontra durante a trensmissão por via sexual. Atualmente, pensa-se que as CD desempenhem um papel importante na transmissão do VIH para os linfócitos, durante o momento em que o vírus é capturado na mucosa.[40] Acredita-se que a presença da proteína FEZ-1, que ocorre naturalmente em neurónios, impeça que o VIH infecte as células.[41]
Replicação e trasncrição
Pouco depois do capsídeo viral penetrar na célula, uma enzima denominada trenscriptase reversa liberta o genoma ARN de cadeia única das proteínas virais, e copia-o para uma molécula complementar de ADN.[42] O processo de transcrição reversa é extremamente predisposto a erros e as mutações daí resultantes podem provocar resistência aos anti-virais ou permitir ao vírus evadir o sistema imunitário. A transcriptase reversa tem também atividade de ribonuclease, que degrada o ARN viral durante a síntese de ADN complementar, assim como atividade de ADN polimerase ADN-dependente, capaz de criar ADN de sentido positivo a partir do ADN complementar de sentido negativo.[43] Juntos, o ADN complementar e o seu complemento forma um ADN viral de cadeia dupla que é assim transportado para o núcleo celular. A integração do ADN viral com o genoma das células anfitriãs é realizada por outra enzima viral, denominada integrase.[42]

O ADN viral, agora integrado na célula, pode permanecer dormente durante a fase latente da infeção.[42] De forma ao vírus poder ser produzido de forma ativa, têm que estar presentes determinados fatores de transcrição, o mais importante dos quais o NF-κB (factor nuclear kappa B), que é depois supra-regulado quando os linfócitos T são ativados.[44]
Durante a replicação viral, o AND proviral integrado é transcrito para ARNm, que é depois reorganizado através de splicing em partes mais pequenas. Estas partes são exportadas do núcleo para o citoplasma, onde são transcritas para as proteínas reguladoras Tat (que incentiva a produção de novos vírus) e Rev. À medida que as proteínas Rev recém-formadas se acumulam no núcleo, vão-se ligando ao ARNm viral e permitem ao ARN que ainda não sofreu splicing abandonar o núcleo, onde de outra forma são retidos até sofrerem splicing.[45]
Recombinação
Em cada partícula de VIH-1 estão encapsidados dois genomas ARN. Durante a infeção e replicação catalisadas pela transcriptase reversa, pode ocorrer recombinação entre estes dois genomas.[46][47] A recombinação ocorre quando os genomas ARN+ de cadeia única são transcritos reversamente para formar ADN. Durante a trenscrição reversa o novo ADN pode alternar diversas vezes entre as duas cópias do ARN viral. Esta forma de recombinação é denominada cópia-escolha. Os processos de recombinação podem ocorrer ao longo de todo o genoma, e entre 2 e 20 eventos por genoma em cada ciclo de replicação. Estes eventos podem alterar rapidamente a informação genética que é transmitida dos genomas progenitores para os descendentes.[47]
A recombinação viral produz variação genética que é provável que contribua para a evolução da resistência à terapia antiviral.[48] A recombinação pode também contribuir, em princípio, para vencer as defesas imunitárias do hospedeiro. No entanto, para que as vantagens adaptativas da variação genética ocorram, os dois genomas virais contidos em cada uma das partículas de vírus devem ter origem em diferentes vírus progenitores e de constituição genética distinta. Não se sabe ainda com que frequência este fenómeno ocorre em condições naturais.[49]
Um estudo sugeriu que a alternância do modelo por parte da transcriptase reversa atua como processo de reparação das quebras no genoma ssARN.[50] Outro estudo sugeriu que a recombinação é uma adaptação tendo em vista a reparação de danos nos genomas ARN.[46] A variação na troca de fita pela transcriptase reversa poderia gerar uma cópia não danificada de ADN genómico a partir de duas cópias danificadas de genoma ssARN. Este ponto de vista dos benefícios da recombinação no VIH poderia explicar porque é que cada partícula de VIH contém dois genomas completos, em vez de apenas um. Além disso, no ponto de vista que sustenta que a recombinação no VIH é um processo de reparação está implícito que esse benefício possa ocorrer a cada ciclo de replicação, e que o benefício possa ser conseguido quer os genomas sejam ou não diferentes em termos genéticos.[50]
A infeção por VIH-1 provoca um processo inflamatório contínuo e a produção de espécies reativas de oxigénio.[51] Assim, o genoma do VIH pode ser vulnerável a danos de oxidação, incluindo quebras no ARN de fita única. No caso do VIH, e para todos os vírus de forma genérica, a infeção bem sucedida está dependente de superar as estratégias defensivas do hospedeiro, que normalmente incluem a produção de oxigénio reativo capaz de destruir genoma. Um estudo sugeriu que a recombinação por parte dos vírus é uma adaptação com o objetivo de reparar os danos no genoma, e que a variação na recombinação é um subproduto que pode trazer benefícios acrescidos.[52]
Montagem e lençamento

O último passo do ciclo viral, a montagem dos viriões do novo VIH-1, tem início na membrana de plasma da célula anfitriã. A poliproteína Env (gp160) atravessa o retículo endoplasmático e é transportada para o complexo de Golgi, onde é dividida pela furina, dando origem às duas glicoproteínas do envelope do VIH, gp41 e gp120.[53] Estas proteínas são transportadas para a membrana plasmática da célula anfitriã, na qual a gp41 fixa a gp120 à membrana da célula infetada. As poliproteínas Gag (p55) e Gag-Pol (p160) também interagem com a superfície interior da membrana plasmática, em conjunto com o ARN genómico do VIH, à medida que o virião em formação começa a despontar da célula anfitriã. Este novo virião encontra-se ainda imaturo, uma vez que as poliproteínas Gag precisam ainda de ser separadas em proteínas de matriz, capsídeo e nucleocapsídeo.Esta divisão é mediada pela protease viral e pode ser inibida por fármacos antirretrovirais da classe dos inibidores da protease. Finalmente, os vários componentes são montados de modo a produzir um virião de VIH amadurecido, que são os únicos capazs de infetar outras células.[54]
Variabilidade genética=

O VIH difere de grande parte dos vírus na medida em que possui uma imensa variabilidade genética. Esta diversidade é resultado do seu rápido ciclo de replicação, capaz de gerar 1010 viriões por dia; de uma elevada taxa de mutação, de cerca de 3 x 10−5 por nucleobase por ciclo de replicação; e das propriedades recombinativas da transcriptase reversa.[55][56][57]
Este esquema complexo leva a que sejam produzidas diversas variantes de VIH por dia num paciente infetado com VIH.[55] Esta variabilidade é agravada quando uma célula é simultaneamente infetada por duas ou mais estirpes de VIH. Quando ocorre infeção em simultâneo, o genoma dos viriões progenitores pode ser constituído por fitas de ARN de duas estirpes diferentes. Este virião híbrido infeta depois uma nova célula, onde se replicará. Enquanto isto acontece, a transcriptase reversa, ao alternar entre dois padrões diferentes de ARN, vai gerar uma nova sequência de ADN retroviral que é uma recombinação entre os dois genomas progenitores.[55] Esta recombinação é mais óbvia quando ocorrer entre subtipos.[55]
O vírus da imunodeficiência símia (VIS) evoluiu para diversas estirpes, classificadas em função da espécie do hospedeiro natural. Pensa-se que as estirpes de VIS dos géneros Chlorocebus (VISagm) e Cercocebus atys (VISsmm) tenham tido uma longa história evolutiva em paralelo com os seus hospedeiros. Estes hospedeiros adaptaram-se à presença do vírus,[58] que está presente em grande quantidade no seu sangue mas espoleta apenas uma resposta imune moderada,[59] não provoca o aparecimento da SIDA símia,[60] e nem sofre as amplas mutações e recombinações típicas da infeção do VIH em seres humanos.[61]
Em contraste, quando estas estirpes infetam espécies que não estão adaptadas ao VIS, os animais desenvolvem SIDA e o vírus gera diversidade genética semelhante à que é observada na infeção humana com o VIH..[62] O SIV em chimpanzés (VIScpz), o parente genético mais próximo do VIH-1, está associado a maior mortalidade e sintomas semelhantes à SIDA no seu hospedeiro natural.[63] O VIScpz aparenta ter sido transmitido aos chimpanzés e à população humana há relativamente pouco tempo, pelo que os seus hospedeiros não estão ainda adaptados ao vírus.[58] Este vírus também perdeu a função do gene Nef que está presente na maior parte dos VIS; sem esta função, é mais provável que ocorra a diminuição dos linfócitos T, levando à imunodeficiência.[63]
Foram identificados três grupos de VIH-1 com base nas diferenças entre a região do envelope (env): M, N e O.[64] O grupo M é o mais prevalente e é subdividido em oito subtipos (ou clados) com base no genoma completo, que são distintos em termos geográficos.[65] Os mais prevalentes são os subtipos B (encontrados principalmente na Europa e América do Norte), A e D (encontrados principalmente em África), e C (encontrado principalmente em África e na Ásia). Estes subtipos formam ramos na árvore filogénica que representam a linhagem do grupo M do VIH-1. A co-infeção com diferentes subtipos suscita formas recombinantes circulantes (FRC ou, em inglês, CRF). Em 2000, o último ano em que foi feita uma análise da prevalência à escala global dos subtipos, 47,2% das infeções eram do subtipo C, 26,7% eram do subtipo A/CRF02_AG, 12,3% eram do subtipo B, 5,3% do subtipo D, 3,2% eram CRF_AE, e os restantes 5,3% eram constituídos por outros subtipos e formas recombinantes.[66] Grande parte da investigação relativa ao VIH-1 está focada no subtipo B e poucos laboratórios se focam nos restantes subtipos.[67] Tem sido colocada a hipótese de um outro grupo "P", com base num vírus isolado em 2009. A estirpe aparenta ser derivada do VIS do gorila (VISgor), isolada pela primeira vez em 2006.[68]
Diagnóstico

Muitos seropositivos desconhecem que estão infetados com o vírus. Por exemplo, em 2001, menos de 1% da população urbana sexualmente ativa em África tinha sido testada, sendo esta percentagem ainda menor entre a população rural. No mesmo ano, só 0,5% das mulheres grávidas que tiveram uma consulta em áreas urbanas foram aconselhadas, examinadas ou receberam os resultados dos testes e, igualmente, esta percentagem é inferior em áreas rurais.[69] Uma vez que os dadores de sangue podem não estar conscientes da sua infeção, o sangue doado é sistematicamente examinado em relação à presença de VIH.[70]
O teste de VIH-1 é inicialmente feito através de um exame ELISA, que deteta a presença de anticorpos do VIH-1. Indivíduos com resultado não reativo ao primeiro exame são considerados seronegativos, até que se verifique nova exposição a um parceiro infetado. Indivíduos com resultado positivo são novamente testados.[71] Se o resultado de ambos os testes é reativo, o indivíduo é classificado como duplamente reativo e submetido e exames de confirmação com testes complementares mais específicos (por exemplo, western blot ou, menos comum, imunofluorescência. Apenas os indivíduos que são duplamente reativos pelo ELISA e positivos por imunofluorescência ou reativos pelo western blot é que são considerados seropositivos e indicadores da presença de uma infeção com o VIH. Alguns indivíduos que são duplamente reativos ao ELISA, ocasionalmente têm resultados indeterminados com western blot, o que pode significar tanto uma resposta incompleta dos anticorpos ao VIH numa pessoa infetada, como reações não-específicas numa pessoa não infetada.[72] Embora a imunofluorescência possa ser usada para confirmar a infeção nestes casos ambíguos, este ensaio não é amplamente usado. Regra geral, deve ser colhida uma segunda amostra mais de um mês depois da primeira, e novamente testadas as pessoas com resultados indeterminados de western blot. Embora seja muito menos comum, o exame com ácido nucleico pode auxiliar o diagnóstico em determinadas situações.[71]
Os exames de VIH modernos são extremamente precisos. Um único exame apresenta resultados corretos em mais de 99% dos casos.[73] Estima-se que a probabilidade da ocorrência de um resultado falso positivo no exame protocolar seja de apenas 1 em 250 000, numa população de baixo risco.[73] É recomendado que, após uma exposição ao VIH, os exames sejam feitos de imediato, a seis semanas, a três meses e a seis meses.[74]
História

O HIV-1 foi descoberto e identificado como causador da AIDS por Luc Montagnier e Françoise Barré-Sinoussi da França e Odete Ferreira de Portugal em 1983 no Instituto Pasteur na França. O HIV-2 foi descoberto por Odete Ferreira de Portugal em Lisboa em 1985.
Sua descoberta envolveu uma grande polêmica, pois cerca de um ano após Montagnier anunciar a descoberta do vírus, chamando-o de LAV (vírus associado à linfoadenopatia), Robert Gallo publicou a descoberta e o isolamento do HTLV-3. Posteriormente se descobriu que o vírus de Gallo era geneticamente idêntico ao de Montagnier, e que possivelmente uma amostra enviada pelo francês havia contaminado a cultura de Gallo.
O último boletim da UNAIDS projeta cerca de 33,2 milhões de pessoas que vivem com o HIV em todo o mundo no final de 2007, a maioria na África. Segundo a UNAIDS (2008), dois terços dos infectados estão na África sub-saariana.[6]
Nos Estados Unidos, infectar voluntariamente outro indivíduo configura transmissão criminosa do HIV. Acontece o mesmo em muitos países ocidentais, inclusive no Brasil.
O vírus do HIV adaptou-se à espécie humana a partir de símios SIV.
Nas pessoas com HIV, o vírus pode ser encontrado no sangue, no esperma, nas secreções vaginais e no leite materno.
Assim, uma pessoa pode adquirir o HIV por meio de relações sexuais, sem proteção - camisinha -, com parceiros portadores do vírus, transfusões com sangue contaminado e injeções com seringas e agulhas contaminadas. Mulheres grávidas portadoras de HIV podem transmitir o vírus para o feto através da placenta, durante o parto ou até mesmo por meio da amamentação. A transmissão de doenças de mãe para filho é chamada de transmissão vertical.
Na África subsaariana, principalmente na África do Sul, por muitos anos houve um movimento contrário à existência do HIV, por parte de membros do governo, aliada a inúmeras superstições e mitos, apesar das comprovações científicas. Por isso em alguns locais dessa região a quantidade de indivíduos infectados é de mais de 35%.[75]
Reprodução em laboratório do genoma viral
Em 2010, pesquisadores da Universidades Federais de Pernambuco e do Rio de Janeiro, da equipa do professor do Departamento de Genética da UFPE, Sergio Crovella, divulgaram trabalho de investigação dirigido à obtenção de uma vacina terapêutica de vírus recombinante, tendo reproduzido artificialmente o genoma do vírus. [76][77] [78]
Prémio Nobel da Medicina 2008 no Parlamento Europeu
Laureado com o Prémio Nobel da Medicina em 2008 por ter descoberto o vírus da imunodeficiência humana (VIH) em 1983, Luc Montagnier esteve no Parlamento Europeu, no dia 1 de Abril de 2009, no âmbito da Conferência dedicada ao "Futuro da investigação biomédica no séc. XXI". Em entrevista exclusiva ao sítio oficial do Parlamento Europeu LA UNE, o médico francês referiu que "o principal objectivo [da investigação científica do VIH] deve ser a criação de uma vacina terapêutica, não nos devemos centrar na vacina preventiva".[79]
Transmissão

O vírus é mais frequentemente transmitido pelo contacto sexual (característica que faz da AIDS uma doença ou infecção sexualmente transmissível), pelo sangue (inclusive em transfusões), durante o parto (mãe para o filho), durante a gravidez ou no aleitamento.
No Brasil, em 2002, a cobertura de exames de HIV em grávidas foi estimada em 52%, sendo pior no Nordeste com 24% e melhor no Sul com 72% de cobertura. Somente 27% seguiram todas as recomendações do Ministério da Saúde. Ter maior escolaridade e morar em cidades com mais de 500 mil habitantes foram os melhores preditores de grávidas que fazem todos os exames. [80] Ainda relativo ao Brasil, o Ministério da Saúde oferece gratuitamente o leite substituto em alguns postos de saúde, hospitais e farmácias cadastrados.
No caso de transmissão pelo sangue, é mais provável por seringas compartilhadas entre usuários de drogas ou caso seja feita reutilização.
Algumas pessoas consideram a possibilidade de transmissão pelo beijo, porém é altamente improvável, pois o vírus é danificado por 10 substâncias diferentes presentes na saliva. Além disso existem poucas células CD4 na boca. Ter boa higiene oral e tomar os medicamentos diminui as possibilidades ainda mais. Mesmo em pessoas com AIDS (carga viral no sangue por volta de 100.000/ml) é difícil encontrar HIV na saliva. [81]
Características
No Brasil, nos últimos anos a transmissão do HIV, que antes era mais frequente entre os homens homossexuais, passou a afetar todas as classes sociais, etnias, lugares e orientações sexuais. Quatro processos podem ser identificados na sua difusão atual[82]:
- Heterossexualização (aumento entre os heterossexuais, que já são a maioria);
- Feminização (aumento entre mulheres, cerca de 1/3 dos casos no Brasil);
- Interiorização (aumento nas cidades do interior);
- Pauperização (aumento nas populações mais pobres).
Fatores de risco
No contacto sexual, pode ser qualquer tipo de sexo, como oral, vaginal e anal. A transmissão do HIV durante o contacto sexual pode ser facilitada por vários factores, incluindo:
- Penetração sem camisinha;
- Ser o receptor (passivo) na relação sexual [83];
- Presença concomitante de doenças sexualmente transmissíveis, especialmente aquelas que levam ao aparecimento de feridas genitais;
- Lesões genitais durante a relação sexual;
- Elevado número de parceiros sexuais e relações desprotegidas;
- Carga viral elevada da pessoa infectada;
- Hemorróida avançada;
- Uso de drogas injetáveis;
- Transtornos psicológicos associados a descaso com a própria saúde;
- Falta de conhecimento.
Outro dado observado é o aumento na proporção de pessoas com escolaridade mais baixa e em adultos com mais de 30 anos.
Fatores de proteção

Alguns dos fatores que diminuem a probabilidade da transmissão são:
- Usar sempre preservativo masculino ou preservativo feminino corretamente;
- Usar lubrificante (pois resulta em menos microferimentos);
- Baixa quantidade de vírus no portador;
- Tomar os medicamentos antirretrovirais corretamente;[85]
- Circuncisão masculina. [86] (porém há estudos com resultados controversos)
Em um estudo longitudinal de 20 meses de duração com casais heterossexuais sorodiferentes, de 124 casais que usaram sempre camisinha nenhum contaminou seu parceiro, enquanto 12 dos 121 que usavam camisinha inconsistentemente foram infectados.[84]
Também são raros os casos de transmissão por ferimentos, pois apesar de haver relatos esporádicos, o vírus não resiste muito tempo fora do corpo e é necessário que haja contato com o sangue tanto por parte do portador como do receptor. É pouco provável que o sangue contaminado em contato com uma pele saudável (sem ferimentos) contamine outra pessoa, apesar de ser possível, pois existem muitos fatores envolvidos.
O uso da terapia antirretroviral diminui em 96% o risco de transmissão do HIV. Por isso os remédios podem ser receitados aos parceiros não infectados de soropositivos. [87]
No caso de profissionais de saúde, é possível tomar os medicamentos antirretrovirais para prevenir a infecção por 28 dias caso o contágio tenha ocorrido em menos de 72h. O risco estimado de contaminação por contato com uma agulha contaminada é de 0,3%. [88] [89]
No Brasil, pacientes que tenham experienciado situação com alto nível de contágio (como sexo anal sem camisinha com pessoa de sorologia desconhecida) há menos de 72h podem solicitar ao médico que prescreva antirretrovirais para prevenir a contaminação.[90]
Sinais e sintomas
Infecção aguda inicial

Assim que se adquire o HIV, o sistema imunológico reage na tentativa de eliminar o vírus. Cerca de 15 a 60 dias depois, pode surgir um conjunto de sinais e sintomas semelhantes ao estado gripal, o que é conhecido como síndrome da soroconversão aguda.
A infecção aguda pelo HIV é uma síndrome inespecífica, que não é facilmente percebida devido à sua semelhança com a infecção por outros agentes virais como a mononucleose, gripe, até mesmo dengue ou muitas outras infecções virais. Mas os sintomas mais comuns da infecção aguda são:
- Febre persistente
- Cansaço e Fadiga
- Erupção cutânea
- Perda de peso rápida
- Diarréia que dure mais de uma semana
- Dores musculares
- Dor de cabeça
- Tosse seca prolongada
- Lesões roxas ou brancas na pele ou na boca
Além disso, muitos desenvolvem linfadenopatia. Faringite, mialgia e muitos outros sintomas também ocorrem.[91]
Em geral esta fase é auto-limitada e não há sequelas. Por ser muito semelhante a outras viroses, dificilmente os pacientes procuram atendimento médico e raramente há suspeita da contaminação pelo HIV, a não ser que o paciente relate ocorrência de sexo desprotegido ou compartilhamento de seringas, por exemplo. Entretanto, na fase aguda inicial, mesmo sem tratamento adequado, os sintomas são temporários.
Progressão
Os pacientes poderão ficar assintomáticos por um período variável entre 3 e 20 anos e alguns nunca desenvolverão doença relacionada ao HIV. Este fato relaciona-se com a quantidade e qualidade dos receptores de superfície dos linfócitos e outras células do sistema imune. Tais receptores (os principais são o CD4, CCR5 e CXCR4) funcionam como fechaduras que permitem a entrada do vírus no interior das células: quanto maior a quantidade e afinidade dos receptores com o vírus,maior será a sua penetração nas células, maior a replicação viral e maior velocidade de progressão para doença.
Foi criada então uma classificação não muito rígida:
- Rápido progressor (adoece em até 3 anos)
- Médio progressor (adoece entre 4 e 7 anos)
- Longo progressor (entre 8 e mais anos)
Estas características são determinadas por fatores genéticos e outros fatores desconhecidos. Não obstante, os hábitos e a qualidade de vida podem ser determinantes da velocidade de progressão da doença, tendo em conta o impacto de fatores como tabagismo, alcoolismo, toxicodependência, estresse, alimentação irregular e outros.
A velocidade de progressão está relacionada com a queda da contagem de linfócitos T CD4 no sangue (a contagem normal dos linfócitos varia de 1.000 a 2.500 células/ml de sangue) e com a contagem da carga viral do HIV (a contagem da carga viral é considerada alta acima de 100.000 cópias/ml de sangue. A escala para carga viral é habitualmente logarítmica. Com o tratamento adequado, a carga viral tende a ficar abaixo de 50 cópias/ml.
O HIV destrói os linfócitos CD4 gradativamente (em média a contagem declina 80-100 células/ml/ano). A contagem relaciona-se inversamente com a gravidade da doença. Para fins de tratamento com as drogas antirretrovirais consideram-se os seguintes parâmetros:
- Abaixo de 200 células/ml: Muito vulnerável, tratar imediatamente;
- Entre 200 e 350 células/ml: Vulnerável, deve ser iniciado o tratamento para evitar riscos;
- Entre 350 e 500 células/ml: Pouco vulnerável, pode começar a critério médico;
- Acima de 500: Saudável, não precisa começar o tratamento.
Porém todos os pacientes com doença oportunista relacionada ao HIV devem ser tratados mesmo com CD4 alto.
Doenças oportunistas
Os sinais e sintomas das doenças relacionadas ao HIV são extremamente variáveis. Uma característica importante é a contagem de linfócitos T CD4. As doenças oportunistas mais comuns que podem sinalizar a contaminação por HIV são:
- Tuberculose
- Neurotoxoplasmose
- Candidíase
- Pneumocistose recorrente
- Sarcoma de Kaposi
- Linfomas
- Câncer cervical
- Infecções bacterianas severas
Geralmente apenas pessoas que desconhecem que estão com o vírus adoecem e só descobrem que estão contaminadas por causa das coinfecções. Tomar os antirretrovirais retorna a imunidade a níveis saudáveis, prevenindo essas e outras doenças. Quando uma dessas doenças é diagnosticadas alguns médicos recomendam que sejam feitos testes para verificar a presença do HIV. [92] Apesar de correlacionadas ao HIV, é importante lembrar que é possível que essas doenças estejam presentes mesmo sem o vírus do HIV, geralmente relacionado a outro fator que leve a uma queda grave da imunidade.
Prevenção
Com o surgimento das Terapias Antirretrovirais (TAR), foram desenvolvidas estratégias de prevenção primária (antes da infecção), secundária (após a doença) e terciária (após agravamento). Entretanto a epidemia continua a contaminar anualmente 2,7 milhões de pessoas, segundo dados da OMS de 2008.[7]
Em 2006, o médico da OMS Brian G. William defendeu a circuncisão masculina na África como método eficaz de prevenção (60% de eficácia).[93] O mesmo médico em fevereiro de 2010 defendeu em San Diego o uso de antirretrovirais com baixos efeitos colaterais por pessoas sem o vírus como meio de frear a epidemia.[8]
Segundo a Organização Não-Governamental sem fins lucrativos IAVI (International AIDS vaccine iniciative) o HIV infecta quase 7.400 pessoas por dia e uma vacina com 50% de eficácia distribuída para 30% da população mundial poderia proteger 5.6 milhões de indivíduos. Em conjunto com 40 laboratórios, o grupo trabalha na vacina desde 1996. Até agora nenhuma vacina teve mais de 33% de eficácia [9].
Em um estudo recente que incluiu o Brasil, o uso de um comprimido de antirretroviral (tenofovir) por homens saudáveis preveniu 44% de novas infecções, chegando a 72% nos pacientes que tomaram o remédio em mais de 90% dos dias. [94]
Mães soropositivas que tomem o antirretroviral durante a gravidez tem apenas de 1 a 2% de chance de transmitir o HIV ao filho. Muitas grávidas ainda tem medo de fazer o teste e/ou se recusam por não se identificarem como possíveis portadoras mesmo sem saber a sorologia do parceiro. Por isso, campanhas de conscientização estão sendo feitas em vários hospitais públicos no Brasil desde 2000.[95]
Após situação de risco
Caso um dos parceiros seja diagnosticado como HIV positivo e o outro como HIV negativo, é possível, a critério médico, prescrever os antirretrovirais para o parceiro soronegativo também, para prevenir a infecção. [96]
De forma semelhante, em vários países inclusive no Brasil, é possível solicitar antirretrovirais gratuitamente a um médico até 72h após uma situação de risco (como sexo anal sem camisinha). Esse tratamento preventivo dura aproximadamente um mês e é eficaz na prevenção de HIV em mais de 80% dos casos. É uma opção do médico prescrever ou não, mas o paciente pode procurar outros médicos em caso de recusa. Em uma pesquisa em uma parada gay nos Estados Unidos 7% dos entrevistados já tomaram antirretrovirais preventivamente. (Mais informações no site da sociedade brasileira de infectologia[10])
O genoma viral
O HIV tem muitos genes que codificam proteínas estruturais.
- Genes retrovírus gerais
- gag. proteínas derivadas do gag sintetizam o capsídeo viral em forma de cone (p24, i.e. proteína de 24 Quilo[[dáltons, CA) a proteína do núcleocapsídeo (p17, NC) e um proteína da matriz (MA).
- pol. O gene pol codifica as proteínas enzimaticamente ativas do vírus. A mais importante é a chamada transcriptase reversa (RT) que realiza a única transcrição reversa do RNA viral em uma cadeia dupla de DNA. O último é integrado ao genoma do hospedeiro, ou seja, em um cromossomo de uma célula infectada de uma pessoa HIV-positiva pela integrase (IN) pol-codificadora. Além disso, a pol codifica uma protease viral específica (PR). Essa enzima cliva o gag e as proteínas derivadas de gag e pol em pedaços funcionais.
- env. env, abreviação para "envelope". As proteínas derivadas de env são uma membrana de superfície (gp120) e uma proteína transmembrana (gp41). Elas estão localizadas na parte externa da partícula viral, formando um envelope viral o qual permite que o vírus se anexe e incorpore às células-alvo para então iniciar o ciclo infeccioso. A gp possui uma estrutura semelhante a uma maçaneta.

- Genes específicos do HIV
- tat. Um porção da estrutura do RNA do HIV é uma estrutura como um grampo de cabelo que inicialmente impede que uma transcrição completa ocorra. Parte do RNA é transcrita (ie. antes da parte do grampo) e codifica a proteína tat. A tat liga-se à CdK9/CycT e a fosforila, ajudando a alterar sua forma e a eliminar o efeito da estrutura de grampo do RNA. Isso por si só aumenta a taxa de transcrição, fornecendo um ciclo de retroalimentação positiva. Isto permite que o HIV tenha uma resposta explosiva, uma vez que uma grande quantidade de tat é produzida.
- rev. A rev permite que fragmentos do mRNA do HIV que contém uma unidade de resposta a rev (RRE) sejam exportados do núcleo ao citoplasma. Na ausência da rev, a maquinaria de splicing do RNA no núcleo rapidamente cliva o RNA. Na presença da rev, o RNA é exportado do núcleo antes de ser clivado, num mecanismo de retroalimentação positiva.
Centros de Testagem e Aconselhamento no Brasil

No Brasil, o Ministério da Saúde oferece gratuitamente exames para detectar a resposta do organismo ao vírus do HIV. Podem ser feitos em Centros de Testagem e Aconselhamento (CTA) e em alguns hospitais.
Primeiro é efectuado um teste ELISA. Caso o resultado seja positivo ou haja dúvidas, é feito o Western-blot, um exame mais eficaz na detecção mas que também é mais caro e complexo. É importante lembrar que, como ambos os exames detectam a resposta imunológica ao vírus, é necessário esperar de 30 a 90 dias depois do contágio para o exame ser mais preciso (ver: janela imunológica).
O resultado é sigiloso, sendo geralmente entregue pessoalmente ao paciente que pode ser seguido em consulta de aconselhamento por profissionais de saúde, de forma a alertar sobre os riscos, encaminhar para outros serviços de saúde e a serviços de acompanhamento psicossocial.
Além do HIV, são feitos simultaneamente exames para sífilis, Hepatite B e Hepatite C pois elas também são doenças sexualmente transmissíveis transmissíveis pelo sangue e que podem levar a danos permanentes e morte se não tratadas corretamente.
É possível encontrar o CTA mais próximo da sua moradia no site do Fique Sabendo: [11].
Tratamento

Hoje, os pacientes têm acesso a um regime complexo de drogas que atacam o HIV em vários estágios do seu ciclo de vida. Elas são conhecidas como medicamentos antirretrovirais e incluem[97]:
- Inibidores Nucleosídeos da Transcriptase Reversa (NRTI): Danificam o RNA do vírus indiretamente ao atuar na enzima transcriptase reversa, impedindo-o de se reproduzir. Exemplos: Zidovudina, Abacavir, Didanosina, Estavudina, Lamivudina e Tenofovir.
- Inibidores Não Nucleosídeos da Transcriptase Reversa (NNRTI): Bloqueiam diretamente a ação da enzima e a multiplicação do vírus. Exemplos: Efavirenz, Nevirapina e Etravirina.
- Inibidores da Protease (IP): Atuam bloqueando a protease, uma enzima usada pelo vírus para produção de novas cópias de células infectadas. Exemplos: Amprenavir, Atazanavir, Darunavir, Indinavir, Lopinavir, Nelfinavir, Ritonavir e Saquinavir.
- Inibidores de fusão: Bloqueiam os receptores que permitiriam a entrada do vírus na célula. Exemplo: Enfuvirtida.
- Inibidores da Integrase: bloqueiam a atividade da enzima integrase, responsável pela inserção do DNA do HIV ao DNA humano (código genético da célula). Assim, inibe a replicação do vírus e sua capacidade de infectar novas células. Exemplo: Raltegravir.
Muitas questões importantes estão envolvidos no estabelecimento de um curso de tratamento para o HIV como a tolerância ao medicamento e efeitos colaterais apresentados. Efeitos colaterais comuns incluem náusea e diarréia, dano e falência do fígado e icterícia. Qualquer tratamento requer testes regulares de sangue para avaliar a eficácia através da contagem de linfócitos T CD4+ no sangue total e a carga viral) no plasma, além de averiguar efeitos colaterais. Alterações de medicamentos são feitas para que o paciente tenha um mínimo de efeitos colaterais, ou mesmo que não apresente nenhum, o que é frequente após o primeiro mês de tratamento.
Não existe nenhum caso conhecido no qual a terapia antiviral tenha eliminado a infecção pelo HIV, porém com o tratamento é possível ter uma vida perfeitamente saudável e assintomática por mais de três décadas (não se sabe por quanto tempo o tratamento continua eficaz pois a TARV só existe há desde 94).
HIV e estupro
Em caso de estupro, como a violência do ato aumenta a probabilidade de contágio, um médico pode prescrever antirretrovirais para diminuir a probabilidade de o vírus conseguir entrar no CD4 e se reproduzir. Geralmente são receitados junto com pílulas do dia seguinte. O mesmo procedimento pode ser prescritos para profissionais que tiveram contato com o sangue de pacientes contaminados, por exemplo através de cirurgia ou de agulha contaminada. Se o TARV for tomado em menos de 72h, é eficaz na prevenção da infecção por HIV.
HIV e Saúde mental
Pacientes com transtornos psicológicos são mais vulneráveis a serem infectados com HIV.[98] Portadores de HIV tem altos índices de depressão maior, alcoolismo e tendência ao suicídio.[99] Em outro estudo também identificaram correlação com transtornos de ansiedade, transtornos sexuais e abuso de substâncias. [100]
Um antirretroviral ITRNN muito usado no mundo, o Efavirenz, também tem como possível efeito colateral transtornos neuropsiquiátricos crônicos, principalmente na forma de transtornos de ansiedade e de sono. [101]
A revelação do diagnóstico de HIV positivo é considerado um evento muito estressante e com impacto em várias áreas da vida do portador, de modo semelhante a outras doenças que ameaçam a vida. [102] A maioria dos portadores reagiu ao diagnóstico como um evento traumatizante, porém conseguiram lidar com a situação sem muitos problemas psicossociais. Os portadores que desenvolveram transtornos psicológicos beneficiaram de psicoterapia de longo prazo, principalmente da terapia interpessoal em conjunto com remédios psiquiátricos.[103] A Terapia cognitivo-comportamental também demonstrou ser uma intervenção benéfica e aumentar a adesão ao tratamento. [104]
Mesmo com o desenvolvimento da terapia antirretroviral altamente eficaz (HAART) a não-adesão ao tratamento ainda é frequente. É recomendado que os profissionais de saúde trabalhem em equipe, desenvolvendo programas específicos para lidar com essa demanda e dediquem mais tempo e atenção aos pacientes com dificuldade de adesão para evitar o desenvolvimento de AIDS e doenças oportunistas nesses pacientes. [105]
Imunidade
Após a infecção inicial, o sistema imunológico inicia uma série de reações para tentar conter a multiplicação do vírus no corpo. Elas incluem a produção de anticorpos e o desenvolvimento de células capazes de identificar e eliminar outras células que foram infectadas pelo HIV, chamadas linfócitos T CD8+ citotóxicos. Infelizmente, a resposta imunológica não é capaz de controlar o vírus na grande maioria das pessoas que se infectam pelo vírus. O HIV passa, então, a destruir cada vez mais as células T CD4+. Quando as células T CD4+ estão em número muito baixo no sangue (em geral, quando ficam abaixo de 200 células por microlitro de sangue), o paciente fica mais predisposto a desenvolver doenças que se aproveitam de sua fragilidade imunológica, daí o nome de doenças oportunistas.
Cerca de 10% de todos os europeus carregam um polimorfismo do CCR5, um receptor de superfície celular que participa nas infecções por HIV-1 M-trófico. Segundo Grimaldi (2002), na população brasileira, cerca de 5,3% carregam essa mutação. O HIV-1 M-trófico usa os receptores CCR5 e CD4 para entrar nas células-alvo, diferentemente do HIV T-trófico que usa o CXCR4 com o CD4. Pessoas com essa mutação (uma deleção de 32 pares de bases) têm um risco muito baixo de infecção pelo HIV-1, já que o HIV M-trófico geralmente inicia a infecção. De fato, 1% de todos os europeus homozigotos para o polimorfismo podem ter uma proteção adicional (apesar de incompleta).
Mitos comuns a respeito do HIV

- "AIDS e HIV são a mesma coisa" - O HIV é um vírus que pode levar ao desenvolvimento da AIDS. Que ocorre quando o sistema imune fica comprometido pela ação do vírus. Alguns tipos de doenças oportunistas do HIV podem estar presentes em uma pessoa que possa ser diagnosticada como tendo AIDS. Uma pessoa pode estar infectada por anos sem ter desenvolvido a AIDS. Alguém que seja HIV positivo pode não ter AIDS.
- "O HIV afeta apenas homossexuais e usuários de drogas" - O HIV pode afetar qualquer um. Bebês, mulheres, idosos, adolescentes, e pessoas de qualquer etnia, classe social e país podem contrair o HIV. Alguns religiosos disseram e ainda dizem que a AIDS é uma punição divina aos homossexuais ou a promiscuidade, porém se isso fosse verdade não deveriam haver contaminados pela mãe durante o nascimento, em transplantes de órgãos, por doação de sangue ou ferimentos.
- "Homossexuais, prostitutas e usuários de drogas são os grupos de risco" - O termo grupos de risco é evitado atualmente por razões éticas, para não estigmatizar este ou aquele grupo, e também para que as pessoas fora do grupo de risco mantenham-se cautelosas. Prefere-se usar o termo comportamento de risco (como não usar preservativo, manter sexo com mais de um parceiro(a), compartilhar seringas). Apesar disso a ONU faz referência a uma maior vulnerabilidade à infecção pelo HIV por algumas populações como profissionais do sexo e seus clientes, população carcerária e homens que fazem sexo com homens.[106][107] Ainda segundo a ONU, em 2008, os jovens eram os mais vulneráveis já que representavam 45% do total de novas infecções.[108] No Brasil, entre os homens infectados 20,1% são homossexuais e 11,5% bissexuais, mas a maioria dos infectados são heterossexuais. Dentre os infectados, segundo dados do SUS de 2009, cerca de 37,5% eram mulheres. [109] O mesmo ocorre na maioria dos outros países. [107]
- "Não há risco para duas pessoas já infectadas ao ter sexo sem proteção" - Há anos a reinfecção por HIV (ou superinfecção como é às vezes chamada) tem sido vista como a consequência de relações sexuais sem proteção entre pessoas infectadas pelo HIV. A reinfecção ocorre quando uma pessoa com HIV infecta-se pela segunda vez ao ter uma relação sexual sem proteção com outra pessoa que também tem o HIV. A reinfecção tem sido demonstrada em estudos laboratoriais, bem como em modelos animais. Por anos, as provas de que isso poderia acontecer em situações da vida real tem sido difíceis de serem obtidas, mas uma evidência recente tem emergido em estudos de casos humanos que confirmou que a reinfecção pelo HIV pode ocorrer e pode ser muito problemática para pessoas com o HIV.
- "Pessoas acima dos 50 anos não contraem HIV" - Pessoas acima dos 50 anos podem contrair HIV. O número de pessoas acima dos 50 diagnosticadas com infecção pelo HIV está aumentando. Em geral, pessoas mais velhas tendem a desenvolver deficiência imunológica mais rápido que os adultos mais jovens.
- "Uma mulher HIV positivo não pode dar à luz um bebê saudável" - o HIV é às vezes transmitido da mãe para o bebê no útero, mas nem sempre. O risco é pelo menos de 20 a 30% para a transmissão materno-fetal do HIV. O parto por cesárea e a ingestão de medicamentos antiretrovirais durante a gravidez pode reduzir as chances de a mãe passar a infecção para o bebê; Quando esses tratamentos estão disponíveis e a futura mãe é diagnosticada o mais cedo possível, apenas cerca de 2% das mães HIV-positivas que estão prestes a dar à luz, terão filhos infectados. As infecções podem ocorrer também através do leite materno sendo recomendado usar aleitamento artificial para evitar que isso ocorra. No Brasil o substituto de leite materno em pó está disponível gratuitamente em alguns hospitais da rede pública.
- "Uma única pessoa identificada trouxe o HIV para a América do Norte" - Ver verbete Paciente Zero.
- A expectativa de vida de vida de uma portador de HIV é de alguns anos - Sem tratamento a expectativa média é de 9 a 11 anos[110]. E caso só seja detectada quando o quadro de AIDS já está instalado e não for feito o tratamento adequado, a expectativa é de apenas 6 a 19 meses[111]. Mas com o avanço dos retrovirais a expectativa aumentou para 20-50 anos.[111] É possível que seja maior pois o HIV só começou a ser estudado mais intensamente por volta de 1985 e a terapia antirretroviral eficaz só chegou ao Brasil por volta de 1996. Como vários laboratórios do mundo estão procurando novos tratamentos é provável que a expectativa aumente cada vez mais e tenha cada vez menos efeitos colaterais[112].
- Picada de mosquito transmite HIV? - Não há relatos conhecidos de infecção por mosquitos no mundo.[carece de fontes]
- Beijo transmite HIV - Existe um risco teórico, porém é quase nulo. Não há nenhum caso confirmado de infecção pelo beijo no mundo. Mesmo em pacientes com AIDS (carga viral média acima de 100.000) e com doenças na cavidade oral menos de 1/3 tinham vestígios do vírus na boca. Em um paciente seguindo o tratamento retro-viral corretamente (carga viral menor que 100) é tão improvável que em 2009 o ministério da saúde brasileiro começou uma campanha contra esse preconceito. Existem 10 substâncias na saliva que destroem o vírus. [113]
- Quem tem HIV pegou fazendo sexo desprotegido - Provavelmente pela forte campanha de prevenção focalizada no uso da camisinha muita gente pense isso. Mas não necessariamente, até 1996, nem todo sangue ou órgão era examinado corretamente antes da transfusão. Além disso, até 2000 menos da metade das mães faziam todos os exames pré-natal indicados e tanto complicações durante a gestação, durante o parto ou no leite podem transmitir o HIV. Mesmo quem foi contaminado sexualmente pode ter sido vítima de estupro (a violência do ato aumenta o risco de transmissão) ou pode ter sido contaminado antes das campanhas de conscientização terem se popularizado nos anos 90.
- Quem tem HIV é mais vulnerável a infecções oportunistas - Com o tratamento antirretroviral (TARV) é possível o portador ter uma vida perfeitamente saudável, sem qualquer sintomas nem efeitos colaterais e com um sistema imunológico normal. E a quantidade do vírus geralmente fica centenas de milhares de vezes menor que o de um paciente com AIDS. Caso o paciente tome os remédios corretamente ele não tem nenhuma restrição.
- Depois de beber não se deve ingerir os medicamentos antirretrovirais - O álcool faz mal por diversos outros motivos, então é bom evitar para não desgastar o organismo e a saúde, porém ele não interage medicamentosamente com a maioria dos tratamentos antirretrovirais. Portanto mesmo após consumir álcool deve-se ingerir os medicamentos normalmente! Uma exceção é a interação com o efavirenz que tem seus possíveis efeitos colaterais como depressão, insonia e dor de cabeça potencializados pelo álcool.
- Assim que a pessoa descobrir que é portador ela deve começar o tratamento - Apenas caso os sintomas da AIDS já tenham aparecido. Mas caso feitos antes dos sintomas podem demorar anos antes de começar o tratamento. O tratamento só começa quando a imunidade está seriamente comprometida. Existem alguns casos de pacientes que foram contaminados há mais de 12 anos e ainda não precisaram tomar o antirretroviral mas geralmente leva de 4 a 7 anos desde a infecção inicial.
Ver também
- AIDS
- HIVBr18
- Barebacking
- Exame de HIV
- Peter Duesberg
- Hipótese de Duesberg
- HIV/AIDS na África
- HIV-integrase
- Reavaliação da AIDS
- Retroviridae
- Robert Gallo
- UNAIDS
- Vírus da imunodeficiência símia
Referências
- ↑ Weiss RA (1993). «How does HIV cause AIDS?». Science. 260 (5112): 1273–9. Bibcode:1993Sci...260.1273W. PMID 8493571. doi:10.1126/science.8493571
- ↑ Douek DC, Roederer M, Koup RA (2009). «Emerging Concepts in the Immunopathogenesis of AIDS». Annu. Rev. Med. 60: 471–84. PMC 2716400
 . PMID 18947296. doi:10.1146/annurev.med.60.041807.123549
. PMID 18947296. doi:10.1146/annurev.med.60.041807.123549
- ↑ PMID 20598938 (20598938 &dopt=Abstract PubMed)
- ↑ Garg, H; Mohl, J; Joshi, A (Nov 9, 2012). «HIV-1 induced bystander apoptosis.». Viruses. 4 (11): 3020–43. PMID 23202514
- ↑ Kumar, Vinay (2012). Robbins Basic Pathology 9th ed. [S.l.: s.n.] p. 147. ISBN 9781455737871
- ↑ International Committee on Taxonomy of Viruses (2002). «61.0.6. Lentivirus». National Institutes of Health. Consultado em February 28, 2006 Verifique data em:
|acessodata=(ajuda) - ↑ International Committee on Taxonomy of Viruses (2002). «61. Retroviridae». National Institutes of Health. Consultado em February 28, 2006 Verifique data em:
|acessodata=(ajuda) - ↑ Lévy, J. A. (1993). «HIV pathogenesis and long-term survival». AIDS. 7 (11): 1401–10. PMID 8280406. doi:10.1097/00002030-199311000-00001
- ↑ Smith JA, Daniel R (2006). «Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses». ACS Chem Biol. 1 (4): 217–26. PMID 17163676. doi:10.1021/cb600131q
- ↑ Gilbert, PB; McKeague, IW; Eisen, G; Mullins, C; Guéye-Ndiaye, A; Mboup, S; Kanki, PJ (February 28, 2003). «Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal». Statistics in Medicine. 22 (4): 573–593. PMID 12590415. doi:10.1002/sim.1342 Verifique data em:
|data=(ajuda) - ↑ Reeves JD, Doms RW (2002). «Human Immunodeficiency Virus Type 2». Journal of General Virology. 83 (Pt 6): 1253–65. PMID 12029140. doi:10.1099/vir.0.18253-0
- ↑ McGovern SL, Caselli E, Grigorieff N, Shoichet BK (2002). «A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening». Journal of Medical Chemistry. 45 (8): 1712–22. PMID 11931626. doi:10.1021/jm010533y
- ↑ Comparação: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-8215-5 Page 3
- ↑ a b c d e f g Various (2008). HIV Sequence Compendium 2008 Introduction (PDF). [S.l.: s.n.] Consultado em March 31, 2009 Verifique data em:
|acessodata=(ajuda) - ↑ a b c Chan DC, Fass D, Berger JM, Kim PS (1997). «Core structure of gp41 from the HIV envelope glycoprotein» (PDF). Cell. 89 (2): 263–73. PMID 9108481. doi:10.1016/S0092-8674(00)80205-6. Consultado em March 31, 2009 Verifique data em:
|acessodata=(ajuda) - ↑ National Institute of Health (June 17, 1998). «Crystal structure of key HIV protein reveals new prevention, treatment targets» (Nota de imprensa). Consultado em September 14, 2006. Cópia arquivada em February 19, 2006 Verifique data em:
|acessodata=, |arquivodata=, |data=(ajuda) - ↑ Ouellet DL, Plante I, Landry P; et al. (2008). «Identification of functional microRNAs released through asymmetrical processing of HIV-1 TAR element». Nucleic Acids Res. 36 (7): 2353–65. PMC 2367715
 . PMID 18299284. doi:10.1093/nar/gkn076
. PMID 18299284. doi:10.1093/nar/gkn076
- ↑ Klase Z, Winograd R, Davis J; et al. (2009). «HIV-1 TAR miRNA protects against apoptosis by altering cellular gene expression». Retrovirology. 6 (1): 18. PMC 2654423
 . PMID 19220914. doi:10.1186/1742-4690-6-18
. PMID 19220914. doi:10.1186/1742-4690-6-18
- ↑ Garcia JV, Miller AD (1991). «Serine phosphorylation-independent downregulation of cell-surface CD4 by nef». Nature. 350 (6318): 508–11. Bibcode:1991Natur.350..508G. PMID 2014052. doi:10.1038/350508a0
- ↑ Schwartz O, Maréchal V, Le Gall S, Lemonnier F, Heard JM (1996). «Endocytosis of major histocompatibility complex class I molecules is induced by the HIV-1 Nef protein». Nat. Med. 2 (3): 338–42. PMID 8612235. doi:10.1038/nm0396-338
- ↑ Stumptner-Cuvelette P, Morchoisne S, Dugast M; et al. (2001). «HIV-1 Nef impairs MHC class II antigen presentation and surface expression». Proc. Natl. Acad. Sci. U.S.A. 98 (21): 12144–9. Bibcode:2001PNAS...9812144S. PMC 59782
 . PMID 11593029. doi:10.1073/pnas.221256498
. PMID 11593029. doi:10.1073/pnas.221256498
- ↑ a b c Coakley E, Petropoulos CJ, Whitcomb JM (2005). «Assessing ch vbgemokine co-receptor usage in HIV». Curr. Opin. Infect. Dis. 18 (1): 9–15. PMID 15647694. doi:10.1097/00001432-200502000-00003
- ↑ Deng H, Liu R, Ellmeier W, Choe S, Unutmaz D, Burkhart M, Di Marzio P, Marmon S, Sutton RE, Hill CM, Davis CB, Peiper SC, Schall TJ, Littman DR, Landau NR (1996). «Identification of a major co-receptor for primary isolates of HIV-1». Nature. 381 (6584): 661–6. Bibcode:1996Natur.381..661D. PMID 8649511. doi:10.1038/381661a0
- ↑ Feng Y, Broder CC, Kennedy PE, Berger EA (1996). «HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor». Science. 272 (5263): 872–7. Bibcode:1996Sci...272..872F. PMID 8629022. doi:10.1126/science.272.5263.872
- ↑ Knight SC, Macatonia SE, Patterson S (1990). «HIV I infection of dendritic cells». International Review of Immunology. 6 (2–3): 163–75. PMID 2152500. doi:10.3109/08830189009056627
- ↑ Tang J, Kaslow RA (2003). «The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy». AIDS. 17 (Suppl 4): S51–S60. PMID 15080180. doi:10.1097/00002030-200317004-00006
- ↑ Zhu T, Mo H, Wang N, Nam DS, Cao Y, Koup RA, Ho DD (1993). «Genotypic and phenotypic characterization of HIV-1 patients with primary infection». Science. 261 (5125): 1179–81. Bibcode:1993Sci...261.1179Z. PMID 8356453. doi:10.1126/science.8356453
- ↑ van’t Wout AB, Kootstra NA, Mulder-Kampinga GA, Albrecht-van Lent N, Scherpbier HJ, Veenstra J, Boer K, Coutinho RA, Miedema F, Schuitemaker H. (1994). «Macrophage-tropic variants initiate human immunodeficiency virus type 1 infection after sexual, parenteral, and vertical transmission». J Clin Invest. 94 (5): 2060–7. PMC 294642
 . PMID 7962552. doi:10.1172/JCI117560
. PMID 7962552. doi:10.1172/JCI117560
- ↑ Zhu T, Wang N, Carr A, Nam DS, Moor-Jankowski R, Cooper DA, Ho DD (1996). «Genetic characterization of human immunodeficiency virus type 1 in blood and genital secretions: evidence for viral compartmentalization and selection during sexual transmission». J Virol. 70 (5): 3098–107. PMC 190172
 . PMID 8627789
. PMID 8627789
- ↑ Muciaccia B, Padula F, Vicini E, Gandini L, Lenzi A, Stefanini M (2005). «Beta-chemokine receptors 5 and 3 are expressed on the head region of human spermatozoon». FASEB J. 19 (14): 2048–50. PMID 16174786. doi:10.1096/fj.05-3962fje
- ↑ Berlier W, Bourlet T, Lawrence P, Hamzeh H, Lambert C, Genin C, Verrier B, Dieu-Nosjean MC, Pozzetto B, Delezay O (2005). «Selective sequestration of X4 isolates by human genital epithelial cells: Implication for virus tropism selection process during sexual transmission of HIV». J Med Virol. 77 (4): 465–74. PMID 16254974. doi:10.1002/jmv.20478
- ↑ Clevestig P, Maljkovic I, Casper C, Carlenor E, Lindgren S, Naver L, Bohlin AB, Fenyo EM, Leitner T, Ehrnst A (2005). «The X4 phenotype of HIV type 1 evolves from R5 in two children of mothers, carrying X4, and is not linked to transmission». AIDS Res Hum Retroviruses. 5 (21): 371–8. PMID 15929699. doi:10.1089/aid.2005.21.371
- ↑ Moore JP (1997). «Coreceptors: implications for HIV pathogenesis and therapy». Science. 276 (5309): 51–2. PMID 9122710. doi:10.1126/science.276.5309.51
- ↑ Karlsson A, Parsmyr K, Aperia K, Sandstrom E, Fenyo EM, Albert J. (1994). «MT-2 cell tropism of human immunodeficiency virus type 1 isolates as a marker for response to treatment and development of drug resistance». J Infect Dis. 170 (6): 1367–75. PMID 7995974. doi:10.1093/infdis/170.6.1367
- ↑ Koot M, van 't Wout AB, Kootstra NA, de Goede RE, Tersmette M, Schuitemaker H. (1996). «Relation between changes in cellular load, evolution of viral phenotype, and the clonal composition of virus populations in the course of human immunodeficiency virus type 1 infection». J Infect Dis. 173 (2): 349–54. PMID 8568295. doi:10.1093/infdis/173.2.349
- ↑ Cheney K, McKnight A (2010). «HIV-2 Tropism and Disease». Lentiviruses and Macrophages: Molecular and Cellular Interactions. [S.l.]: Caister Academic Press. ISBN 978-1-904455-60-8
- ↑ a b c d e f g Chan D, Kim P (1998). «HIV entry and its inhibition». Cell. 93 (5): 681–4. PMID 9630213. doi:10.1016/S0092-8674(00)81430-0
- ↑ a b c d e f Wyatt R, Sodroski J (1998). «The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens». Science. 280 (5371): 1884–8. Bibcode:1998Sci...280.1884W. PMID 9632381. doi:10.1126/science.280.5371.1884
- ↑ Arthos J, Cicala C, Martinelli E, Macleod K, Van Ryk D, Wei D, Xiao Z, Veenstra TD, Conrad TP, Lempicki RA, McLaughlin S, Pascuccio M, Gopaul R, McNally J, Cruz CC, Censoplano N, Chung E, Reitano KN, Kottilil S, Goode DJ, Fauci AS (2008). «HIV-1 envelope protein binds to and signals through integrin alpha(4)beta(7), the gut mucosal homing receptor for peripheral T cells». Nature Immunology. In Press (3): 301–9. PMID 18264102. doi:10.1038/ni1566
- ↑ a b Pope M, Haase A (2003). «Transmission, acute HIV-1 infection and the quest for strategies to prevent infection». Nat Med. 9 (7): 847–52. PMID 12835704. doi:10.1038/nm0703-847
- ↑ doi:10.1073/pnas.0900502106
Esta predefinição está obsoleta; veja{{Cite doi}}para mais informações. Esta citação não está completa. Você pode completá-la manualmente - ↑ a b c Zheng YH, Lovsin N, Peterlin BM (2005). «Newly identified host factors modulate HIV replication». Immunol. Lett. 97 (2): 225–34. PMID 15752562. doi:10.1016/j.imlet.2004.11.026
- ↑ «IV. VIRUSES - F. ANIMAL VIRUS LIFE CYCLES 3. The Life Cycle of HIV». Doc Kaiser's Microbiology Home Page. Community College of Baltimore County. January 2008 Verifique data em:
|data=(ajuda) - ↑ Hiscott J, Kwon H, Genin P (2001). «Hostile takeovers: viral appropriation of the NF-kB pathway». J Clin Invest. 107 (2): 143–151. PMC 199181
 . PMID 11160127. doi:10.1172/JCI11918
. PMID 11160127. doi:10.1172/JCI11918
- ↑ Pollard VW, Malim MH (1998). «The HIV-1 Rev protein». Annu. Rev. Microbiol. 52: 491–532. PMID 9891806. doi:10.1146/annurev.micro.52.1.491
- ↑ a b Hu WS, Temin HM. (1990). Retroviral recombination and reverse transcription. Science 250(4985):1227-1233. PMID 1700865
- ↑ a b Charpentier C, Nora T, Tenaillon O, Clavel F, Hance AJ. (2006). Extensive recombination among human immunodeficiency virus type 1 quasispecies makes an important contribution to viral diversity in individual patients. J Virol 80(5):2472-2482. PMID 16474154 Free PMC Article
- ↑ Nora T, Charpentier C, Tenaillon O, Hoede C, Clavel F, Hance AJ. (2007). Contribution of recombination to the evolution of human immunodeficiency viruses expressing resistance to antiretroviral treatment. J Virol 81(14):7620-7628. PMID 17494080 Free PMC Article
- ↑ Chen J, Powell D, Hu WS. (2006). High frequency of genetic recombination is a common feature of primate lentivirus replication. J Virol 80(19):9651-9658. PMID 16973569 Free PMC Article
- ↑ a b Bonhoeffer S, Chappey C, Parkin NT, Whitcomb JM, Petropoulos CJ. (2004). Evidence for positive epistasis in HIV-1. Science 2004 306(5701):1547-1550. Erratum in: Science. 2008 May 9;320(5877):746. PMID 15567861 Free Article
- ↑ Israël N, Gougerot-Pocidalo MA. (1997). Oxidative stress in human immunodeficiency virus infection. Cell Mol Life Sci 53(11-12):864-870. PMID 9447238
- ↑ Michod RE, Bernstein H, Nedelcu AM (2008). Adaptive value of sex in microbial pathogens. Infect Genet Evol 8(3):267-285. PMID 18295550 http://www.hummingbirds.arizona.edu/Faculty/Michod/Downloads/IGE%20review%20sex.pdf
- ↑ Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W (November 26, 1992). «Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160». Nature. 360 (6402): 358–61. Bibcode:1992Natur.360..358H. PMID 1360148. doi:10.1038/360358a0 Verifique data em:
|data=(ajuda) - ↑ Gelderblom HR (1997). «Fine structure of HIV and SIV» (PDF). In: Los Alamos National Laboratory. HIV sequence compendium. [S.l.]: Los Alamos National Laboratory. pp. 31–44
- ↑ a b c d Robertson DL, Hahn BH, Sharp PM. (1995). «Recombination in AIDS viruses». J Mol Evol. 40 (3): 249–59. PMID 7723052. doi:10.1007/BF00163230
- ↑ Rambaut, A; Posada, D; Crandall, KA; Holmes, EC (2004). «The causes and consequences of HIV evolution». Nature Reviews Genetics. 5 (52–61): 52–61. PMID 14708016. doi:10.1038/nrg1246
- ↑ Perelson AS, Ribeiro RM (2008). «Estimating drug efficacy and viral dynamic parameters: HIV and HCV». Stat Med. 27 (23): 4647–57. PMID 17960579. doi:10.1002/sim.3116
- ↑ a b PMID 19661993 (PubMed)
- ↑ Holzammer S, Holznagel E, Kaul A, Kurth R, Norley S (2001). «High virus loads in naturally and experimentally SIVagm-infected African green monkeys». Virology. 283 (2): 324–31. PMID 11336557. doi:10.1006/viro.2001.0870
- ↑ Kurth, R. and Norley, S. (1996). «Why don't the natural hosts of SIV develop simian AIDS?». J. NIH Res. 8: 33–37
- ↑ Baier M, Dittmar MT, Cichutek K, Kurth R (1991). «Development of vivo of genetic variability of simian immunodeficiency virus». Proc. Natl. Acad. Sci. U.S.A. 88 (18): 8126–30. Bibcode:1991PNAS...88.8126B. PMC 52459
 . PMID 1896460. doi:10.1073/pnas.88.18.8126
. PMID 1896460. doi:10.1073/pnas.88.18.8126
- ↑ Daniel MD, King NW, Letvin NL, Hunt RD, Sehgal PK, Desrosiers RC (1984). «A new type D retrovirus isolated from macaques with an immunodeficiency syndrome». Science. 223 (4636): 602–5. Bibcode:1984Sci...223..602D. PMID 6695172. doi:10.1126/science.6695172
- ↑ a b PMID 19626114 (PubMed)
- ↑ Thomson MM, Perez-Alvarez L, Najera R (2002). «Molecular epidemiology of HIV-1 genetic forms and its significance for vaccine development and therapy». Lancet Infectious Diseases. 2 (8): 461–471. PMID 12150845. doi:10.1016/S1473-3099(02)00343-2
- ↑ Carr JK, Foley BT, Leitner T, Salminen M, Korber B, McCutchan F (1998). «Reference sequences representing the principal genetic diversity of HIV-1 in the pandemic» (PDF). In: Los Alamos National Laboratory (ed.). HIV sequence compendium (PDF). Los Alamos, New Mexico: Los Alamos National Laboratory. pp. 10–19
- ↑ Osmanov S, Pattou C, Walker N, Schwardlander B, Esparza J; WHO-UNAIDS Network for HIV Isolation and Characterization (2002). «Estimated global distribution and regional spread of HIV-1 genetic subtypes in the year 2000». Acquired Immune Deficiency Syndrome. 29 (2): 184–190. PMID 11832690
- ↑ Perrin L, Kaiser L, Yerly S. (2003). «Travel and the spread of HIV-1 genetic variants». Lancet Infect Dis. 3 (1): 22–27. PMID 12505029. doi:10.1016/S1473-3099(03)00484-5
- ↑ Plantier JC, Leoz M, Dickerson JE; et al. (2009). «A new human immunodeficiency virus derived from gorillas». Nature Medicine. 15 (8): 871–2. PMID 19648927. doi:10.1038/nm.2016. Resumo divulgativo
- ↑ Kumaranayake L, Watts C (2001). «Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa». Journal of International Development. 13 (4): 451–466. doi:10.1002/jid.797
- ↑ Kleinman S (2004). «Patient information: Blood donation and transfusion». Uptodate. Cópia arquivada em April 12, 2008 Verifique data em:
|arquivodata=(ajuda) - ↑ a b Centers for Disease Control and Prevention (2001). «Revised guidelines for HIV counseling, testing, and referral». MMWR Recomm Rep. 50 (RR–19): 1–57. PMID 11718472
- ↑ Celum CL, Coombs RW, Lafferty W, Inui TS, Louie PH, Gates CA, McCreedy BJ, Egan R, Grove T, Alexander S; et al. (1991). «Indeterminate human immunodeficiency virus type 1 western blots: seroconversion risk, specificity of supplemental tests, and an algorithm for evaluation». J Infect Dis. 164 (4): 656–664. PMID 1894929. doi:10.1093/infdis/164.4.656
- ↑ a b Chou R, Huffman LH, Fu R, Smits AK, Korthuis PT (2005). «Screening for HIV: a review of the evidence for the U.S. Preventive Services Task Force». Annals of Internal Medicine. 143 (1): 55–73. PMID 15998755
- ↑ Tolle MA, Schwarzwald HL (July 15, 2010). «Postexposure prophylaxis against human immunodeficiency virus». American Family Physician. 82 (2): 161–6. PMID 20642270 Verifique data em:
|data=(ajuda) - ↑ Cunha, M. (2007). South African Politics, Inequalities, and HIV/AIDS: Applications for Public Health Education. Journal of Developing Societies 23: 207-219
- ↑ Vacina contra aids entra em nova etapa na UFPE. Profarma, 26 de março de 2010 (matéria publicada originalmente no Jornal do Commercio).
- ↑ Identificados genes que contribuem para a imunização contra o HIV Isaúde.net, 27 de março de 2010.
- ↑ «UFPE cria vírus artificial de HIV». Jornal do Commercio on-line. Consultado em 27-Maio-2010 Verifique data em:
|acessodata=(ajuda) - ↑ «Luc Montagnier: Entrevista exclusiva LA UNE»
- ↑ SANTOS, Naila JS et al. Mulheres HIV positivas, reprodução e sexualidade. Rev. Saúde Pública [online]. 2002, vol.36, n.4, suppl. [cited 2010-02-15], pp. 12-23 . Available from: <http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S0034-89102002000500004&lng=en&nrm=iso>. ISSN 0034-8910. doi: 10.1590/S0034-89102002000500004.
- ↑ DIANE C. SHUGARS e SHARON M. WAHL. The Role of the Oral Environment in HIV-1 Transmission (1998) J Am Dent Assoc, Vol 129, No 7, 851-858.
- ↑ BRITO, Ana Maria de; CASTILHO, Euclides Ayres de and SZWARCWALD, Célia Landmann. AIDS e infecção pelo HIV no Brasil: uma epidemia multifacetada. Rev. Soc. Bras. Med. Trop. [online]. 2001, vol.34, n.2 [cited 2010-02-19], pp. 207-217 . Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0037-86822001000200010&lng=en&nrm=iso>. ISSN 0037-8682. doi: 10.1590/S0037-86822001000200010.
- ↑ European Study Group on Heterosexual Transmission of HIV (1992). "Comparison of female to male and male to female transmission of HIV in 563 stable couples". BMJ. 304 (6830): 809-813
- ↑ a b De Vincenzi, Isabelle. The European Study Group on Heterosexual Transmission of HIV, A Longitudinal Study of Human Immunodeficiency Virus Transmission by Heterosexual Partners, N Engl J Med 1994 331: 341-346
- ↑ http://www.agenciaaids.com.br/site/noticia.asp?id=17257
- ↑ Walter A Eyer-Silva (2003) A circuncisão masculina e a transmissão heterossexual do HIV. Rev. Saúde Pública vol.37 no.5 São Paulo Oct. Disponível em: http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S0034-89102003000500022
- ↑ http://www.estadao.com.br/noticias/geral,retrovirais-reduzem-em-96-risco-de-transmissao-de-hiv-aponta-estudo,718419,0.htm
- ↑ Bell, D. M. (1997). "Occupational risk of human immunodeficiency virus infection in healthcare workers: an overview.". Am. J. Med. 102 (5B): 9-15.
- ↑ Smith, D. K., Grohskopf, L. A., Black, R. J., Auerbach, J. D., Veronese, F., Struble, K. A., Cheever, L., Johnson, M., Paxton, L. A., Onorato, I. A. and Greenberg, A. E. (2005)."Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States. MMWR 54 (RR02): 1-20.
- ↑ Relatório da sociedade brasileira de infectologia [1]
- ↑ Kahn JO, Walker BD. Acute Human Immunodeficiency Vírus type 1 infection. N Engl J Med 1998;331:33-9.
- ↑ LIMA, Mônica M.. HIV/tuberculosis co-infection: a request for a better surveillance. Rev. Saúde Pública [online]. 1997, vol.31, n.3, pp. 217-220. ISSN 0034-8910. [2]
- ↑ Williams BG, Lloyd-Smith JO, Gouws E, Hankins C, Getz WM, et al. 2006 The Potential Impact of Male Circumcision on HIV in Sub-Saharan Africa. PLoS Med 3(7): e262. doi:10.1371/journal.pmed.0030262
- ↑ Robert M. Grant, M.D. e col.(2010) Preexposure Chemoprophylaxis for HIV Prevention in Men Who Have Sex with Men. New england journal of medicine. Novembro
- ↑ Mandú, Edir Nei Teixeira; Dióz, Majoreth. Percepções de grávidas em torno da prevenção da contaminação do hiv e de sua transmissão vertical. Ciênc. cuid. saúde;5(3):344-354, set.-dez. 2006.
- ↑ Reis, Renata Karina; Gir, Elucir. Vulnerabilidade ao HIV/AIDS e a prevenção da transmissão sexual entre casais sorodiscordantes. Rev. Esc. Enferm. USP;43(3):662-669, set. 2009.
- ↑ http://www.aids.gov.br/pagina/quais-sao-os-antirretrovirais
- ↑ F Cournos, M Empfield, E Horwath, K McKinnon, I Meyer, H Schrage, C Currie and B Agosin. HIV seroprevalence among patients admitted to two psychiatric hospitals Am J Psychiatry 1991; 148:1225-1230 Copyright © 1991 by American Psychiatric Association
- ↑ Kelly B; Raphael B; Judd F; Perdices M; Kernutt G; Burrows GD; Burnett PC; Dunne M. Psychiatric disorder in HIV infection. Aust N Z J Psychiatry;32(3):441-53, 1998 Jun.
- ↑ GR Brown, JR Rundell, SE McManis, SN Kendall, R Zachary and L Temoshok. Prevalence of psychiatric disorders in early stages of HIV infection Psychosomatic Medicine, Vol 54, Issue 5 588-601, Copyright © 1992 by American Psychosomatic Society
- ↑ T.A. Rihs; K. Begley; D.E. Smith; J. Sarangapany; A. Callaghan; M. Kelly; J.J. Post; J. Gold. Efavirenz and Chronic Neuropsychiatric Symptoms: a Cross-sectional Case Control Study Posted: 01/31/2007; HIV Medicine. 2006;7(8):544-548. © 2006 Blackwell Publishing. Disponível em (24/02/2010): http://www.medscape.com/viewarticle/550461
- ↑ C Gala, A Pergami, J Catalan, F Durbano, M Musicco, M Riccio, T Baldeweg and G Invernizzi. The psychosocial impact of HIV infection in gay men, drug users and heterosexuals. Controlled investigation The British Journal of Psychiatry 163: 651-659 (1993)© 1993 The Royal College of Psychiatrists. Disponível em: http://bjp.rcpsych.org/cgi/content/abstract/163/5/651
- ↑ Weinel E. Long-term psychotherapy of HIV patients - indications and experiences.Int Conf AIDS. 1990 Jun 20-23; 6: 186 (abstract no. S.B.402). Disponível em: http://gateway.nlm.nih.gov/MeetingAbstracts/ma?f=102196209.html
- ↑ Hans-Joumlrg Znoj e col. Psychotherapeutic process of cognitive-behavioral intervention in HIV-infected persons: Results from a controlled, randomized prospective clinical trial 2008 Impact Factor of 1.579 (2009 Thomson Reuters, 2008 Journal Citation Reports)
- ↑ COLOMBRINI, Maria Rosa Ceccato; LOPES, Maria Helena Baena de Moraes and FIGUEIREDO, Rosely Moralez de. Adesão à terapia antiretroviral para HIV/AIDS. Rev. esc. enferm. USP [online]. 2006, vol.40, n.4 [cited 2010-02-24], pp. 576-581 . Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0080-62342006000400018&lng=en&nrm=iso>. ISSN 0080-6234. doi: 10.1590/S0080-62342006000400018.
- ↑ Nações Unidas - Brasil. A ONU e a Resposta à AIDS no Brasil.[3] Acessado em 13 de janeiro de 2010
- ↑ a b UNAIDS. Relatório global sobre a epidemia de AIDS 2009 – Sumário geral.[4] Acessado em 13 de janeiro de 2010.
- ↑ Rádio das Nações Unidas. Jovens são maior grupo de risco do HIV, diz ONU. [5] Acessado em 13 de janeiro de 2010.
- ↑ http://www.aids.gov.br/sites/default/files/anexos/publicacao/2010/45974/boletim_dst_aids_2010_pdf_19557.pdf
- ↑ UNAIDS, WHO (December 2007). "2007 AIDS epidemic update" (PDF). http://data.unaids.org/pub/EPISlides/2007/2007_epiupdate_en.pdf. Retrieved 2008-03-12.
- ↑ a b Zwahlen M, Egger M (2006) (PDF). Progression and mortality of untreated HIV-positive individuals living in resource-limited settings: update of literature review and evidence synthesis. UNAIDS Obligation HQ/05/422204. http://data.unaids.org/pub/Periodical/2006/zwahlen_unaids_hq_05_422204_2007_en.pdf. Retrieved 2008-03-19.
- ↑ Antiretroviral Therapy Cohort Collaboration (2008). "Life expectancy of individuals on combination antiretroviral therapy in high-income countries: a collaborative analysis of 14 cohort studies". Lancet 372 (9635): 293–9.
- ↑ S. H. Kazmi, J. R. Naglik, S. P. Sweet, R. W. Evans, S. O'Shea, J. E. Banatvala, and S. J. Challacombe; Comparison of Human Immunodeficiency Virus Type 1-Specific Inhibitory Activities in Saliva and Other Human Mucosal Fluids; Clin. Vaccine Immunol., October 1, 2006; 13(10): 1111 - 1118.
Ligações externas
- HIV international travel restrictions and retreats: www.plwha.org
- «Folhas Informativas sobre HIV e AIDS»
- «Portal português de referência na temática do VIH/SIDA»
- «RNP+ Rede Nacional de Pessoas vivendo com HIV/Aids» (em português e inglês)
- «HIV InSite» (em inglês)
- «Associação Brasileira Interdisciplinar de AIDS»
- «Texto sobre a descoberta do HIV, a polêmica envolvida e o prêmio Nobel de Medicina e Fisiologia de 2008»
- «Entrevista inédita com Bia Pacheco.Conheça os trabalhos de destaques ligados ao HIV/AIDS realizados por esta cidadã»
- «Evolução do vírus HIV»
- «HIV na 3ª idade»
- «AIDS e envelhecimento: repercussões na saúde pública.Incidência de HIV na população idosa e tendência à feminização»
- «Nova campanha contra HIV/AIDS veiculada pela Rede Globo.Essa campanha pode ser efetiva?»

