Doença de Alzheimer: diferenças entre revisões
| Linha 150: | Linha 150: | ||
== Prevenção == |
== Prevenção == |
||
[[Ficheiro:Honoré Daumier 032.jpg|thumb|O Alzheimer é quatro vezes mais comum em analfabetos do que em pessoas com mais de oito anos de estudo formal]] |
|||
Atualmente não existem evidências conclusivas que permitam apoiar qualquer medida em concreto para a prevenção de Alzheimer.<ref>{{Citar periódico | autor = Kawas CH | título = Medications and Diet: Protective Factors for AD? | jornal = Alzheimer Disease and Associated Disorders | volume = 20 | número = 3 Supl. 2 | páginas = S89–96 | ano = 2006 | pmid = 16917203 }}</ref><ref>{{Citar periódico | autor = Luchsinger JA, Mayeux R | título = Dietary Factors and Alzheimer's Disease | jornal = Lancet Neurology | volume = 3 | número = 10 | páginas = 579–87 | ano = 2004 | pmid = 15380154 | doi = 10.1016/S1474-4422(04)00878-6 }}</ref><ref>{{Citar periódico | autor = Luchsinger JA, Noble JM, Scarmeas N | título = Diet and Alzheimer's Disease | jornal = Current Neurology and Neuroscience Reports | volume = 7 | número = 5 | páginas = 366–72 | ano = 2007 | pmid = 17764625 | doi = 10.1007/s11910-007-0057-8 }}</ref><ref>{{Citar web |url=http://www.nih.gov/news/health/apr2010/od-28.htm |título=Independent Panel Finds Insufficient Evidence to Support Preventive Measures for Alzheimer's Disease |data=28 de abril de 2010 |publicado=National Institutes of Health}}</ref><ref>{{Citar web |url=http://consensus.nih.gov/2010/alzstatement.htm |título=NIH State-of-the-Science Conference: Preventing Alzheimer's Disease and Cognitive Decline |data= 26–28 de abril de 2010 |autor=Daviglus ML et al.}}</ref> Os estudos globais de medidas para prevenir ou atrasar o desenvolvimento da doença produzem na maior parte das vezes resultados inconsistentes. Os estudos epidemiológicos têm proposto a existência de relações entre a probabilidade de desenvolver Alzheimer e determinados factores modificadores, como o tipo de dieta, o risco cardiovascular, produtos farmacêuticos ou atividades intelectuais, entre outros. No entanto, só uma investigação mais aprofundada, incluindo ensaios clínicos, é que pode confirmar se estes fatores podem ajudar a prevenir a doença.<ref>{{Citar periódico | autor = Szekely CA, Breitner JC, Zandi PP | título = Prevention of Alzheimer's Disease | jornal = International Review of Psychiatry | volume = 19 | número = 6 | páginas = 693–706 | ano = 2007 | pmid = 18092245 | doi = 10.1080/09540260701797944 }}</ref> |
|||
Todos os estudos de medidas para prevenir ou atrasar os efeitos do Alzheimer são frequentemente infrutíferos. Hoje em dia, não parecem existir provas para acreditar que qualquer medida de prevenção é definitivamente bem sucedida contra o Alzheimer. No entanto, estudos indicam relações entre factores alteráveis como dietas, risco cardiovascular, uso de produtos farmacêuticos ou atividades intelectuais e a probabilidade de desenvolvimento de Alzheimer da população. Mas só mais pesquisa, incluídos testes clínicos, revelarão se, de facto, esses factores podem ajudar a prevenir o Alzheimer. |
|||
===Medicamentos=== |
|||
A inclusão de fruta e vegetais, pão, trigo e outros cereais, azeite, peixe, e vinho tinto, podem reduzir o risco de Alzheimer. Algumas [[vitamina]]s como a [[Vitamina B12|B12]], [[Vitamina B3|B3]], [[Vitamina C|C]] ou a [[Vitamina B9|B9]] foram relacionadas em estudos ao menor risco de Alzheimer, embora outros estudos indiquem que essas não têm nenhum efeito significativo no início ou desenvolvimento da doença e podem ter efeitos secundários. Algumas especiarias como a [[curcumina]] e o [[açafrão]] mostraram sucesso na prevenção da degeneração cerebral em ratos de laboratório. |
|||
Embora os fatores de risco cardiovasculares, como a [[hipercolesterolemia]], [[hipertensão arterial]], [[diabetes]] ou o [[tabagismo]], estejam associados a um maior risco de vir a desenvolver Alzheimer,<ref name="pmid18299540">{{Citar periódico | autor = Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD | título = Diagnosis and Treatment of Dementia: 1. Risk Assessment and Primary Prevention of Alzheimer Disease | jornal = Canadian Medical Association Journal | volume = 178 | número = 5 | páginas = 548–56 | ano = 2008 | pmid = 18299540 | pmc = 2244657 | doi = 10.1503/cmaj.070796 | mês = Fevereiro }}</ref><ref name="pmid17483665">{{Citar periódico | autor = Rosendorff C, Beeri MS, Silverman JM | título = Cardiovascular Risk Factors for Alzheimer's Disease | jornal = The American Journal of Geriatric Cardiology | volume = 16 | número = 3 | páginas = 143–9 | ano = 2007 | pmid = 17483665 | doi = 10.1111/j.1076-7460.2007.06696.x }}</ref> as [[estatina]]s (fármacos para a diminuição do [[colesterol]]) não são eficazes na prevenção ou atraso da evolução da doença.<ref name="pmid17927279">{{Citar periódico | autor = Reiss AB, Wirkowski E | título = Role of HMG-CoA Reductase Inhibitors in Neurological Disorders: Progress to Date | jornal = Drugs | volume = 67 | número = 15 | páginas = 2111–20 | ano = 2007 | pmid = 17927279 | doi = 10.2165/00003495-200767150-00001 }}</ref><ref name="pmid17877925">{{Citar periódico | autor = Kuller LH | título = Statins and Dementia | jornal = Current Atherosclerosis Reports | volume = 9 | número = 2 | páginas = 154–61 | ano = 2007 | pmid = 17877925 | doi = 10.1007/s11883-007-0012-9 | mês = Agosto }}</ref> |
|||
O risco cardiovascular, derivado de [[colesterol]] alto, [[hipertensão]], [[diabetes]] e o [[tabaco]], está associado com maior risco de desenvolvimento da doença, e as [[estatina]]s (fármacos para fazer descer o colesterol) não tiveram sucesso em prevenir ou melhorar as condições do paciente durante o desenvolvimento da doença. No entanto, o uso a longo prazo de anti-inflamatórios não-esteroides (AINEs) está também associado à menor probabilidade de desenvolvimento de Alzheimer em alguns indivíduos. Já não se acredita que outros tratamentos farmacêuticos, como substituição de hormonas femininas, previnam a doença. Em 2007, estudo aprofundado concluiu que havia provas inconsistentes e pouco convincentes de que o [[ginkgo]] tenha algum efeito positivo em reduzir a probabilidade de ocorrência do Mal de Alzheimer. |
|||
O uso prolongado de [[anti-inflamatórios não esteroides]] (AINEs) está associado à diminuição da probabilidade de vir a desenvolver Alzheimer.<ref name="pmid17612054">{{Citar periódico | autor = Szekely CA, Town T, Zandi PP | título = NSAIDs for the Chemoprevention of Alzheimer's Disease | jornal = Sub-Cellular Biochemistry | volume = 42 | páginas = 229–48 | ano = 2007 | pmid = 17612054 | doi = 10.1007/1-4020-5688-5_11 | isbn = 978-1-4020-5687-1 | série = Subcellular Biochemistry }}</ref> Os estudos humanos ''[[Autópsia|postmortem]]'', em [[Modelo animal|modelos animais]] ou investigação ''[[in vitro]]'' também apoiam a noção de que os AINEs são capazes de reduzir a inflamação relacionada com as placas amiloides.<ref name="pmid17612054"/> No entanto, os ensaios clínicos que investigaram o seu uso enquanto tratamento paliativo não demonstraram resultados positivos, aparentemente porque a concentração de AINEs no cérebro após a administração oral é muito pequena.<ref>{{Citar periódico |autor=Lehrer S. |título=Nasal NSAIDs for Alzheimer's Disease |jornal=Am J Alzheimers Dis Other Demen. |ano=2014 |mês=Janeiro |pmid=24413537}}</ref> A [[Terapia hormonal|terapia de substituição hormonal]], embora tenha sido usada no passado, pode aumentar o risco de demência.<ref name="pmid22786488">{{Citar periódico | autor = Marjoribanks J, Farquhar C, Roberts H, Lethaby A | título = Long term hormone therapy for perimenopausal and postmenopausal women | joornal = The Cochrane Database of Systematic Reviews | volume = 7 | número = | páginas = CD004143 | ano = 2012 | pmid = 22786488 | doi = 10.1002/14651858.CD004143.pub4 | url = | editor=Farquhar, Cindy}}</ref> |
|||
Atividades intelectuais como ler, escrever com a mão esquerda, disputar jogos de tabuleiro ([[xadrez]], [[damas]], etc.), completar [[palavras cruzadas]], tocar [[instrumento musical|instrumentos musicais]], ou socialização regular também podem atrasar o início ou a gravidade do Alzheimer. Outros estudos mostraram que muita exposição a campos magnéticos e trabalho com metais, especialmente alumínio, aumenta o risco de Alzheimer. A credibilidade de alguns desses estudos tem sido posta em causa até porque outros estudos não encontraram a mínima relação entre as questões ambientais e o desenvolvimento de Alzheimer. |
|||
===Estilo de vida=== |
|||
Muitas vezes não é possível discernir todas as fases da doença, pois um paciente que ainda está na primeira fase já pode apresentar dificuldades de locomoção por exemplo, e outro paciente que já se encontra em fase terminal ainda fala com fluência (embora sejam frases sem sentido nenhum e até mesmo xingamentos). |
|||
[[File:Paris - Playing chess at the Jardins du Luxembourg - 2966.jpg|thumb|As atividades intelectuais, como ler, jogar jogos de tabuleiro, tocar instrumentos musicais e socializar regularmente estão associadas a uma diminuição do risco de Alzheimer em estudos epidemiológicos, embora não se tenha ainda descoberto uma relação causa-efeito.]] |
|||
As pessoas que se envolvem em atividades intelectuais, como a leitura, jogos de tabuleiro, palavras cruzadas, toque de [[instrumentos musicais]] ou que têm [[Relação social|interação social]] de forma regular demonstram menor risco de vir a desenvolver doença de Alzheimer.<ref name="pmid16917199">{{Citar periódico | autor = Stern Y | title = Cognitive reserve and Alzheimer disease | jornal = Alzheimer Disease and Associated Disorders | volume = 20 | número = 2 | páginas = 112–117 | data = Julho de 2006 | pmid = 16917199 | doi = 10.1097/01.wad.0000213815.20177.19 | issn = 0893-0341 }}</ref> Isto é consistente com a teoria da [[reserva cognitiva]], que alega que determinadas experiências de vida levam a uma maior eficiência no funcionamento dos [[neurónio]]s, o que faz com que o indivíduo seja dotado de uma reserva cognitiva que atrasa o aparecimento das manifestações de demência.<ref name="pmid16917199"/> O nível de escolaridade atrasa o desenvolvimento do síndrome de Alzheimer, e não apresenta relação com a diminuição da esperança de vida após o diagnóstico.<ref name="pmid19026089">{{Citar periódico | autor = Paradise M, Cooper C, Livingston G | título = Systematic Review of the Effect of Education on Survival in Alzheimer's Disease | jornal = International Psychogeriatrics | volume = 21 | número = 1 | páginas = 25–32 | ano = 2009 | pmid = 19026089 | doi = 10.1017/S1041610208008053 | mês = Fevereiro }}</ref> Aprender uma segunda língua, mesmo que durante a terceira idade, aparenta atrasar o aparecimento da doença.<ref>{{CItar periódico |url=http://www.neurology.org/content/75/19/1726.short |autor=Fergus I.M. Craik, Ellen Bialystok, Morris Freedman |título=Delaying the onset of Alzheimer disease: Bilingualism as a form of cognitive reserve |doi=10.1212/WNL.0b013e3181fc2a1c |jornal=Neurology |mês=Novembro |ano=2010 |volume=75 |número=19 |páginas=1726-1729}}</ref> A [[Exercício físico|atividade física]] também está associada a um menor risco de Alzheimer.<ref name="pmid19026089"/> |
|||
===Dieta=== |
|||
Em [[2009]], cientistas do [[Reino Unido]] e [[França]] anunciaram a descoberta de três [[gene]]s [clusterina (ou CLU), PICALM e CR1] que poderiam reduzir em até 20% seus índices de incidência na população.<ref>{{citar notícia|url=http://www1.folha.uol.com.br/folha/ciencia/ult306u620225.shtml|titulo=Cientistas anunciam maior avanço contra Alzheimer dos últimos 15 anos|ultimo=Folha|acessodata=06/09/2009}}</ref> |
|||
<!--Dietas --> |
|||
Os consumidores de [[dieta mediterrânica]] apresentam menor risco de vir a desenvolver Alzheimer,<ref>{{Citar periódico | autor = Sofi F, Macchi C, Abbate R, Gensini GF, Casini A | título = Effectiveness of the Mediterranean diet: can it help delay or prevent Alzheimer's disease? | jornal = Journal of Alzheimer's Disease | volume = 20 | número = 3 | páginas = 795–801 | ano = 2010 | pmid = 20182044 | doi = 10.3233/JAD-2010-1418 }}</ref><ref name="pmid18088206">{{Citar periódico | autor = Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F | título = Lifestyle-related Factors in Predementia and Dementia Syndromes | jornal = Expert Review of Neurotherapeutics | volume = 8 | número = 1 | páginas = 133–58 | ano = 2008 | pmid = 18088206 | doi = 10.1586/14737175.8.1.133 | mês = Janeiro }}</ref> podendo até melhorar os resultados em pessoas com a doença.<ref>{{Citar periódico | autor = Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A | título = Diet and Alzheimer's disease risk factors or prevention: the current evidence. | jornal = Expert Review of Neurotherapeutics | volume = 11 | número = 5 | páginas = 677–708 | data = Maio de 2011 | pmid = 21539488 | doi = 10.1586/ern.11.56 }}</ref> Por outro lado, os consumidores de dietas ricas em [[gorduras saturadas]] e [[hidratos de carbono]] simples apresentam maior risco.<ref>{{Citar periódico | autor = Kanoski SE, Davidson TL | título = Western diet consumption and cognitive impairment: links to hippocampal dysfunction and obesity | jornal = Physiology & Behavior | volume = 103 | número = 1 | páginas = 59–68 | data = 18 de abril de 2011 | pmid = 21167850 | pmc = 3056912 | doi = 10.1016/j.physbeh.2010.12.003 }}</ref> O mecanismo de ação proposto tem sido o efeito benéfico a nível cardiovascular da dieta mediterrânica.<ref name="pmid18088206"/> Diversos alimentos ricos em [[flavonoide]]s, como o [[cacau]], [[vinho tinto]] ou o [[chá]], podem diminuir o risco de Alzheimer.<ref>{{Citar periódico | autor = Nehlig A | título = The neuroprotective effects of cocoa flavanol and its influence on cognitive performance | jornal = British Journal of Clinical Pharmacology | volume = 75 | número = 3 | data = Julho de 2012 | pmid = 22775434 | doi = 10.1111/j.1365-2125.2012.04378.x }}</ref><ref>{{Citar periódico | autor = Stoclet JC, Schini-Kerth V | título = Dietary flavonoids and human health | jornal = Annales Pharmaceutiques Françaises | volume = 69 | número = 2 | páginas = 78–90 | data = Março de 2011 | pmid = 21440100 | doi = 10.1016/j.pharma.2010.11.004 }}</ref> No entanto, há poucas evidências que sustentem que o consumo ligeiro a moderado de álcool, em particular de [[vinho tinto]], esteja associado a um menor risco de Alzheimer.<ref>{{Citar periódico | autor = Panza F, Capurso C, D'Introno A, Colacicco AM, Frisardi V, Lorusso M, Santamato A, Seripa D, Pilotto A, Scafato E, Vendemiale G, Capurso A, Solfrizzi V | título = Alcohol Drinking, Cognitive Functions in Older Age, Predementia, and Dementia Syndromes | jornal = Journal of Alzheimer's Disease | volume = 17 | número = 1 | páginas = 7–31 | data = Maio de 2009 | pmid = 19494429 | doi = 10.3233/JAD-2009-1009 }}</ref> Há evidências conjeturais de que a [[cafeína]] possa ser protetora.<ref name="pmid20182026">{{Citar periódico | autor = Santos C, Costa J, Santos J, Vaz-Carneiro A, Lunet N | título = Caffeine intake and dementia: systematic review and meta-analysis | jornal = Journal of Alzheimer's Disease | volume = 20 Supl 1 | número = | páginas = S187–204 | ano = 2010 | pmid = 20182026 | doi = 10.3233/JAD-2010-091387 | url = }}</ref> |
|||
<!--Vitaminas e minerais --> |
|||
Os estudos de revisão sobre o uso de [[vitamina]]s e [[sais minerais]] não encontraram evidências consistentes suficiente que permitam a sua recomendação. Isto inclui a [[vitamina A]],<ref>{{Citar periódico | autor = Ono K, Yamada M | título = Vitamin A and Alzheimer's disease | jornal = Geriatrics & Gerontology International | volume = 12 | número = 2 | páginas = 180–8 | data = Abril de 2012 | pmid = 22221326 | doi = 10.1111/j.1447-0594.2011.00786.x }}</ref><ref>{{Citar periódico | autor = Lerner AJ, Gustaw-Rothenberg K, Smyth S, Casadesus G | título = Retinoids for treatment of Alzheimer's disease. | jornal = BioFactors | volume = 38 | número = 2 | páginas = 84–9 | data = Mar–Abr 2012 | pmid = 22419567 | doi = 10.1002/biof.196 }}</ref> [[vitamina C|C]],<ref>{{Citar periódico | autor = Heo JH, Lee KM | título = The possible role of antioxidant vitamin C in Alzheimer's disease treatment and prevention | jornal = American Journal of Alzheimer's Disease and Other Dementias | volume = 28 | número = 2 | páginas = 120–5 | data = Março de 2013 | pmid = 23307795 | doi = 10.1177/1533317512473193 }}</ref><ref name="pmid16227450">{{Citar periódico | autor = Boothby LA, Doering PL | título = Vitamin C and Vitamin E for Alzheimer's Disease | jornal = The Annals of Pharmacotherapy | volume = 39 | número = 12 | páginas = 2073–80 | ano = 2005 | pmid = 16227450 | doi = 10.1345/aph.1E495 | mês = Dezembro }}</ref> [[vitamina E|E]],<ref name="pmid16227450"/><ref>{{Citar periódico | autor = Isaac MG, Quinn R, Tabet N | título = Vitamin E for Alzheimer's Disease and Mild Cognitive Impairment | jornal = The Cochrane Database of Systematic Reviews | número = 3 | páginas = CD002854 | ano = 2008 | pmid = 18646084 | doi = 10.1002/14651858.CD002854.pub2 }}</ref> [[selénio]],<ref>{{Citar periódico | autor = Loef M, Schrauzer GN, Walach H | título = Selenium and Alzheimer's disease: a systematic review | jornal = Journal of Alzheimer's Disease | volume = 26 | número = 1 | páginas = 81–104 | ano = 2011 | pmid = 21593562 | doi = 10.3233/JAD-2011-110414 }}</ref> [[zinco]],<ref>{{Citar periódico | autor = Loef M, von Stillfried N, Walach H | título = Zinc diet and Alzheimer's disease: a systematic review | jornal = Nutritional Neuroscience | volume = 15 | número = 5 | páginas = 2–12 | data = 1 de setembro de 2012 | pmid = 22583839 | doi = 10.1179/1476830512Y.0000000010 }}</ref> e [[ácido fólico]] com ou sem [[vitamina B12]].<ref>{{Citar periódico | autor = Malouf R, Grimley Evans J | título = Folic Acid with or without Vitamin B12 for the Prevention and Treatment of Healthy Elderly and Demented people | jornal = The Cochrane Database of Systematic Reviews | número = 4 | páginas = CD004514 | ano = 2008 | pmid = 18843658 | doi = 10.1002/14651858.CD004514.pub2 }}</ref> Para além disso, o consumo excessivo de vitamina E está associado a outros riscos de saúde.<ref name="pmid16227450"/> Os ensaios sobre o ácido fólico (vitamina B9) e outras vitaminas B não conseguiram demonstrar qualquer associação relevante com o declínio cognitivo.<ref>{{Citar periódico | autor = Wald DS, Kasturiratne A, Simmonds M | título = Effect of Folic Acid, with or without other B vitamins, on Cognitive Decline: Meta-analysis of Randomized trials | jornal = The American Journal of Medicine | volume = 123 | número = 6 | páginas = 522–527.e2 | data = Junho de 2010 | pmid = 20569758 | doi = 10.1016/j.amjmed.2010.01.017 }}</ref> Em pessoas já com Alzheimer, acrescentar à dieta [[ácido docosa-hexaenoico]], um [[ácido gordo]] [[ómega 3]] não mostrou atrasar o declínio da doença.<ref>{{Citar periódico | autor = Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P | título = Docosahexaenoic acid homeostasis, brain aging and Alzheimer's disease: Can we reconcile the evidence? | jornal = Prostaglandins, Leukotrienes, and Essential Fatty Acids | volume = 88 | número = 1 | páginas = 61–70 | data = Janeiro de 2013 | pmid = 22575581 | doi = 10.1016/j.plefa.2012.04.006 }}</ref> |
|||
<!--Medicina alternativa --> |
|||
A [[curcumina]] não demonstra ter qualquer benefício em seres humanos, embora haja evidências conjeturais em animais.<ref>{{Citar periódico | autor = Hamaguchi T, Ono K, Yamada M | title = REVIEW: Curcumin and Alzheimer's disease | journal = CNS Neuroscience & Therapeutics | volume = 16 | número = 5 | páginas = 285–97 | data = Outubro de 2010 | pmid = 20406252 | doi = 10.1111/j.1755-5949.2010.00147.x | url = }}</ref> Há evidências inconsistentes e pouco convincentes de que o [[Ginkgo biloba|ginkgo]] tenha qualquer efeito positivo no défice cognitivo ou na demência.<ref>{{Citar periódico | autor = Birks J, Grimley Evans J | título = Ginkgo Biloba for Cognitive Impairment and Dementia | jornal = The Cochrane Database of Systematic Reviews | número = 1 | páginas = CD003120 | ano = 2009 | pmid = 19160216 | doi = 10.1002/14651858.CD003120.pub3 }}</ref> Também não há evidências concretas de que os [[canabinoide]]s sejam eficazes na melhoria dos sintomas de Alzheimer ou demência.<ref name="pmid19370677">{{Citar periódico | autor = Krishnan S, Cairns R, Howard R | título = Cannabinoids for the treatment of dementia | jornal = The Cochrane Database of Systematic Reviews | volume = | número = 2 | páginas = CD007204 | ano = 2009 | pmid = 19370677 | doi = 10.1002/14651858.CD007204.pub2 | url = | editor=Krishnan, Sarada }}</ref> No entanto, alguma investigação em fase inicial mostra ser promissora.<ref name="pmid23108550">{{Citar periódico | autor = Bilkei-Gorzo A | título = The endocannabinoid system in normal and pathological brain ageing | jornal =Philos. Trans. R. Soc. Lond., B, Biol. Sci. | volume = 367 | número = 1607 | páginas = 3326–41 | ano = 2012 | pmid = 23108550 | pmc = 3481530 | doi = 10.1098/rstb.2011.0388 | mês = Dezembro }}</ref> |
|||
== Tratamento == |
== Tratamento == |
||
Revisão das 14h36min de 13 de outubro de 2014
| Alzheimer | |
|---|---|
| Comparação entre um cérebro idoso normal (esquerda) e o cérebro de uma pessoa com Alzheimer (direita), estando assinaladas as características diferenciadoras | |
| Especialidade | neurologia |
| Frequência | 5.05% (Europa) |
| Classificação e recursos externos | |
| CID-10 | G30, F00 |
| CID-9 | 331.0, 290.1 |
| CID-11 | 1611724421 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | neuro/13 |
| MeSH | D000544 |
A doença de Alzheimer é a forma mais comum de demência. Não existe cura para a doença, a qual se agrava progressivamente até que eventualmente leva à morte. Foi descrita pela primeira vez em 1906 pelo psiquiatra e neuropatologista alemão Alois Alzheimer, de quem recebeu o nome.[1] A doença é geralmente diagnosticada em pessoas com idade superior a 65 anos,[2] embora possa ocorrer mais cedo. Em 2006, existiam no mundo 26,6 milhões de pessoas com Alzheimer e em 2050 prevê-se que afete 1 em cada 85 pessoas à escala mundial.[3] A doença afeta 1% dos idosos entre os 65 e 70 anos, mas a prevalência aumenta exponencialmente com a idade, sendo de 6% aos 70, 30% aos 80 anos e mais de 60% depois dos 90 anos.[4]
Embora a doença de Alzheimer se manifeste de forma diferente em cada pessoa, existem diversos sintomas em comum.[5] Os primeiros sintomas são geralmente confundidos com sinais relacionados com a idade ou manifestações de stresse.[6] Nos primeiros estágios, o sintoma mais comum é a dificuldade em recordar eventos recentes, o que se denomina perda de memória a curto prazo. Quando se suspeita de Alzheimer, o diagnóstico é geralmente confirmado com exames que avaliam o comportamento e a capacidade de raciocínio da pessoa, os quais podem ser complementados por um exame cerebral.[7] No entanto, só é possível determinar um diagnóstico definitivo através de um exame ao tecido cerebral. À medida que a doença evolui, o quadro de sintomas pode incluir confusão, irritabilidade, alterações de humor, comportamento agressivo, dificuldades com a linguagem e perda de memória a longo prazo. Em grande parte dos casos, a pessoa com Alzheimer afasta-se gradualmente da família e da sociedade.[6][8] Gradualmente, o corpo vai perdendo as funções corporais normais, o que eventualmente leva à morte.[9] Uma vez que a doença se manifesta de forma diferente em cada pessoa, é difícil prever como irá afetar determinada pessoa. Antes de se manifestar por completo, a doença evolui ao longo de um período de tempo desconhecido e variável, podendo progredir ao longo de anos sem ser diagnosticada. Em média, a esperança de vida após o diagnóstico é de cerca de sete anos.[10] Pouco mais de 3% das pessoas vive mais de 14 anos após o diagnóstico.[11]
A doença de Alzheimer é classificada enquanto transtorno neurodegenerativo. As causas e progressão da doença ainda não são completamente compreendidas, embora se saiba que está associada às placas senis e com os novelos neurofibrilares no cérebro.[12] Os tratamentos atuais destinam-se apenas aos sintomas de Alzheimer, não existindo tratamentos para parar ou regredir a progressão da doença. Até 2012, tinham sido realizados mais de mil ensaios clínicos a vários componentes da doença.[13] Como forma de atrasar o desenvolvimento de sintomas cognitivos em idosos saudáveis, tem sido sugerida a realização de exercício físico e mental e uma dieta equilibrada, embora não existam evidências conclusivas em relação a eventuais benefícios.[14]
Uma vez que a doença de Alzheimer não tem cura e é degenerativa, a pessoa afetada torna-se gradualmente dependente da assistência de outros. Em muitos casos, é o cônjugue ou um familiar próximo quem assume o papel de principal cuidador.[15] A doença tem um impacto significativo para os cuidadores, a nível social, psicológico, físico e económico.[16][17][18] Em países desenvolvidos, Alzheimer é uma das doenças com maiores custos sociais.[19][20]
Sintomas
- Efeitos do envelhecimento na memória, mas que não são Alzheimer
- Esquecer-se ocasionalmente das coisas[21]
- Perder ocasionalmente objetos[21]
- Pequenas perdas de memória a curto prazo[21]
- Esquecer-se que ocorreram lapsos de memória[21]
- Estágio inicial de Alzheimer
- Estado de distração ou falta de atenção[21]
- Esquecer-se de compromissos[21]
- Pequenas alterações notadas por familiares próximos[21]
- Alguma confusão em ambientes que não sejam familiares[21]
- Estágio intermédio de Alzheimer
- Dificuldade acrescida em recordar informações recentes[21]
- Confusão crescente num número maior de situações[21]
- Problemas na fala[21]
- Iniciar repetidamente a mesma conversa[21]
- Estágio avançado de Alzheimer
A doença de Alzheimer evolui de forma única em cada pessoa, embora existam sintomas em comum; por exemplo, o sintoma inicial mais comum é a perda de memória. Muitas vezes, os primeiros sintomas da doença são confundidos com os processos normais de envelhecimento ou stress. Quando se suspeita de Alzheimer, o paciente é submetido a uma série de testes cognitivos e radiológicos para confirmar o diagnóstico. Com o avançar da doença vão aparecendo novos sintomas como confusão mental, irritabilidade e agressividade, alterações de humor, falhas na linguagem, perda de memória a longo prazo e o paciente começa a desligar-se da realidade. Antes de se tornar totalmente aparente, a doença de Alzheimer evolui ao longo de um período indeterminado de tempo e pode manter-se assintomática durante anos.[22] A evolução da doença pode ser dividida em quatro fases:
Pré-demência
Os primeiros sintomas são muitas vezes atribuídos, de forma equivocada, ao envelhecimento natural ou ao o stresse.[6] Alguns testes neuropsicológicos podem revelar deficiências cognitivas moderadas até oito anos antes da pessoa cumprir os critérios de diagnóstico de Alzheimer.[23] Estes primeiros sintomas podem afetar algumas das mais complexas atividades do quotidiano.[24] O mais perceptível défice cognitivo na fase inicial é a perda de memória a curto prazo, ou seja, a dificuldade em recordar factos aprendidos recentemente ou em memorizar nova informação.[23][25]
Entre outros possíveis sintomas dos estágios iniciais de Alzheimer estão também problemas subtis com as funções executivas da atenção, planeamento, flexibilidade, raciocínio abstrato ou problemas na memória semântica (memória dos significados e relações afetivas).[23] Durante este estágio pode também ser observada apatia, que é o mais persistente sintoma neuropsiquiátrico ao longo da evolução da doença.[26] Também são comuns sintomas depressivos, irritabilidade e a diminuição da percepção das próprias dificuldades de memória.[27] Este estágio pré-clínico da doença tem também sido denominado défice cognitivo ligeiro,[25] embora ainda se debata se este termo corresponde a um estágio de diagnóstico distinto ou se identifica o primeiro estágio de Alzheimer.[28]
Estágio inicial
A progressiva degeneração da memória e da capacidade de aprendizagem características da doença permitem, a dado momento, que possa ser realizado um diagnóstico conclusivo de Alzheimer. Embora na generalidade dos casos os problemas de memória sejam o sintoma mais evidente, numa pequena percentagem de pessoas são mais proeminentes as dificuldades de linguagem, funções executivas, perceção (agnosia) ou execução de movimentos (apraxia).[29] A doença não afeta todas as capacidades de memória de igual forma. As memórias mais antigas da vida da pessoa (memória episódica), os factos já aprendidos (memória semântica) e a memória implícita (a memória do corpo para realizar ações, como usar um garfo para comer), são menos afetadas pela doença em comparação com novos factos ou memórias recentes.[30][31]
Os problemas na linguagem são caracterizados principalmente pela diminuição do vocabulário e pela diminuição na fluência do discurso, o que leva a um empobrecimento geral da linguagem escrita e oral.[29][32] No entanto, durante este estágio geralmente a pessoa com Alzheimer ainda é capaz de comunicar ideias básicas de forma adequada.[29][32][33] As dificuldades de coordenação e de planeamento (apraxia) podem-se manifestar durante a realização de tarefas motoras finas, como ao escrever, desenhar ou vestir-se, embora sejam geralmente impercetíveis.[29] À medida que a doença progride, as pessoas com Alzheimer conseguem realizar muitas tarefas de forma autónoma, embora possam precisar de assistência ou supervisão para as atividades de maior exigência cognitiva.[29]
Estágio intermédio
A determinado ponto, a progressiva degeneração cognitiva afeta a independência da pessoa, a qual se mostra incapaz de realizar a maior parte das atividades do dia-a-dia.[29] As dificuldades na linguagem tornam-se evidentes devido à incapacidade em se recordar de vocabulário, o que leva a substituições incorretas de palavras de forma frequente (parafasia). As capacidades de leitura e de escrita também são progressivamente perdidas.[29][33] À medida que a doença progride, diminui a coordenação nas sequências motoras mais complexas, pelo que o risco de sofrer uma queda aumenta.[29] Durante esta fase agravam-se também os problemas com a memória e a pessoa pode deixar de reconhecer familiares próximos.[29] Começam também a ser visíveis défices na memória a longo prazo, que em estágios anteriores se mantinha intacta.[29]
Nesta fase, as alterações comportamentais e neuropsiquiátricas tornam-se mais prevalentes. As manifestações mais comuns são um estado geral de confusão e ausência, irritabilidade e episódios incontroláveis de manifestações emotivas, como choro, agressão involuntária ou resistência à prestação de cuidados de saúde.[29] Cerca de 30% das pessoas com Alzheimer desenvolvem sintomas de delírio.[29] As pessoas perdem também a conciência do processo e das limitações da sua própria doença (anosognosia).[29] Pode também aparecer incontinência urinária.[29] Estes sintomas geram stresse para os familiares e cuidadores, que pode ser diminuído inscrevendo a pessoa em apoio domiciliário ou lares de repouso.[29][34]
Estágio avançado (terminal)
Durante a última fase da doença, a pessoa está completamente dependente dos cuidadores. A linguagem é reduzida a frases simples ou até a palavras isoladas, levando eventualmente à perda completa da capacidade de se exprimir verbalmente.[29][33] Apesar da perda da linguagem verbal, muitas vezes as pessoas continuam a compreender e responder a sinais emocionais. Embora a agressividade ainda possa estar presente, a apatia extrema e o cansaço são sintomas muito mais comuns. Nesta fase, as pessoas com a doença acabam eventualmente por não conseguir realizar sem assistência até mesmo as tarefas mais simples. A massa muscular e a mobilidade degeneram-se ao ponto em que a pessoa não consegue sair da cama e perde a capacidade de se alimentar a si própria. Alzheimer é uma doença terminal, em que a causa direta de morte não é a doença em si, mas geralmente um fator externo, como uma infeção por escaras ou pneumonia.[29]
Causas
As causas de maior parte dos casos de Alzheimer são ainda desconhecidas, exceto em 1-5% dos casos onde têm sido identificadas diferenças genéticas.[35] Existem diversas hipóteses que tentam chegar a uma explicação para a origem da doença:
Genética
Com base em revisões de estudos entre gémeos e família, a hereditariedade genética da doença de Alzheimer varia entre 49% e 79%.[36][37] Cerca de 0,1% dos casos são formas familiares de transmissão autossómica dominante, as quais geralmente ocorrem antes dos 65 anos de idade.[38] Esta forma da doença é denominada doença de Alzheimer familiar. A maior parte dos casos de Alzheimer familiar autossómico dominante é atribuída a mutações em um de três genes: os que codificam a proteína precursora amiloide (PPA) e as presenilinas 1 e 2.[39] A maior parte das mutações nestes genes aumenta a produção de uma pequena proteína denominada Aβ42, a qual é o principal componente das placas senis.[40] Algumas das mutações apenas alteram a proporção entre a Aβ42 e as outras formas principais, como a Aβ40, sem no entanto aumentar a quantidade de Aβ42.[40][41] Isto sugere que as mutações das presenilinas podem provocar a doença, mesmo que diminuam a quantidade total de Aβ produzida.[42]
A maior parte dos casos de Alzheimer não evidenciam transmissão autossómica dominante, sendo nesse caso denoominados "doença de Alzheimer esporádica". Nestes casos, as diferenças genéticas e ambientais podem constituir fatores de risco. O fator de risco genético melhor compreendido é a hereditariedade do alelo ε4 da apolipoproteína E (APOE).[43][44] Entre 40 e 80% das pessoas com Alzheimer possuem pelo menos um alelo APOEε4 allele.[44] Este alelo aumenta o risco de vir a sofrer da doença em três vezes nos heterozigotos e quinze vezes nos homozigotos.[38] Tal como em muitas doenças humanas, os fatores ambientais e modificadores genéticos resultam em penetrância incompleta. Por exemplo, algumas populações nigerianas não exibem a relação entre a quantidade de APOEε4 e a incidência ou idade habitual de início da doença observada em outras populações humanas.[45][46] As mutações no gene TREM2 têm sido associadas a um risco 3 a 5 vezes maior de vir a desenvolver Alzheimer.[47][48] Os estudos de associação pengenómica recentes verificaram a existência de dezanove áreas nos genes que aparentam afetar o risco de Alzheimer.[49]
Hipótese colinérgica
A hipótese mais antiga, na qual se baseia a maior parte das terapêuticas farmacológicas, é a hipótese colinérgica.[50] Esta hipótese propõe que a doença de Alzheimer seja provocada por uma insuficiência na síntese do neurotransmissor acetilcolina. Esta hipótese não reúne atualmente apoio generalizado, em grande parte porque a medicação para o tratamento da deficiência em acetilcolina não tem demonstrado ser eficaz. Têm sido também propostos outros efeitos colinérgicos; por exemplo, a agregação em grande escala de amiloides,[51] que provoca neuroinflamação generalizada.[52]
Hipótese amiloide
Em 1991, a hipótese amiloide postulou que os depósitos extrecelulares de beta amiloides (Aβ) são a causa fundamental da doença de Alzheimer.[53][54] Este postulado baseia-se na localização do gene da proteína precursora amiloide no cromossoma 21 e no facto da quase totalidade das pessoas com trissomia 21, as quais têm uma cópia adicional de genes, manifestarem Alzheimer antes dos 40 anos de idade.[55][56] Para além disso, existe uma isoforma específica da apolipoproteína, denominada APOE4, que é um fator de risco genético significativo para a doença. Enquanto que as apolipoproteínas aumentam a separação dos beta amiloides, algumas isoformas, como a APOE4, não são muito eficazes nesta tarefa e provocam a acumulação excessiva de amiloides no cérebro.[57] Existem ainda evidências adicionais na descoberta de que ratos transgénicos que expressam uma forma mutante da APP humana desenvolvem placas amiloides fibrilares e patologia cerebral semelhante a Alzheimer.[58][59][60][61]
Uma vacina experimental demonstrou ser eficaz a eliminar placas de amiloides durante ensaios clínicos em seres humanos, embora não tenha tido qualquer efeito significativo na demência.[62] Isto levou os investigadores a suspeitar de que os oligómeros fossem a principal forma patogénica das Aβ. Estes oligómeros, também denominados ligantes difusos derivados do amiloide (ADDL), ligam-se a um recetor de superfície nos neurónios e alteram a estrutura da sinapse, interrompendo assim a comunicação entre os neurónios.[63] Um dos possíveis recetores dos oligómeros Aβ é a proteína prião, a mesma proteína associada à doença das vacas loucas e à condição humana derivada, a doença de Creutzfeldt-Jakob, pelo que existe a possibilidade destas doenças neurodegenerativas estarem relacionadaa com a doença de Alzheimer.[64] Em 2009 esta hipótese foi atualizada, sugerindo que um dos principais responsáveis pela doença não seria o próprio beta-amiloide, mas um parente próximo da proteína beta-amiloide. Esta teoria sustenta que o mesmo mecanismo amiloidal que desliga as ligações entre os neurónios no cérebro durante o crescimento rápido no início da vida pode ser mais tarde espoletado pelos processos de envelhecimento e provocar a atrofia neuronal da doença de Alzheimer.[65]
Hipótese da proteína Tau

A hipótese da proteína tau propõe que a doença seja desencadeada por anormalidades na proteína tau.[54] Neste modelo, a proteína tau hiperfosforilada começa por se associar a outras cadeias de tau, formando eventualmente novelos neurofibrilares no interior das células nervosas.[66] Quando isto ocorre, os microtúbulos desintegram-se, destruindo o sistema de transporte dos neurónios.[67] Isto pode provocar inicialmente disfunções na comunicação bioquímica entre os neurónios e numa fase posterior a morte das células.[68]
Outras hipóteses
A doença de Alzheimer interrompe a homeostase celular do cobre, ferro, e zinco iónicos, embora não seja ainda claro se isto é causa ou consequência das alterações nas proteínas. Estes iões afetam e são afetados pela proteína tau, APP e APOE.[69] Alguns estudos relevelaram um risco acrescido de desenvolver Alzheimer na presença de alguns fatores ambientais como a ingestão de metais, sobretudo de alumínio.[70] No entanto, a qualidade de alguns destes estudos tem sido alvo de críticas,[71] e outros estudos concluíram que não existe qualquer relação entre estes fatores ambientais e o desenvolvimento de Alzheimer.[72] Alguns investigadores levantaram também a hipótese do cobre na dieta poder desempenhar algum papel de causa.[73]
Embora alguns estudos tenham sugerido que os campos eletromagnéticos de Frequência extremamente baixa possam aumentar o risco de Alzheimer,[74] as revisões posteriores sustentam que esta hipótese requer investigações epidemiológicas e laboratoriais.[75]
O fumo de tabaco é um fator de risco significativo de Alzheimer.[76] Os marcadores sistémicos do sistema imune inato são também fatores de risco para o Alzheimer de aparecimento tardio.[77] Existem também evidências conjeturais de que a exposição à poluição do ar possa constituir um fator para o desenvolvimento de Alzheimer.[78]
Outra hipótese sustenta que a doença possa ser causada pela desagregação da mielina no cérebro devido à idade, processo que liberta ferro e provoca ainda mais lesões. Os processos homeostáticos de reparação da mielina contribuem para o desenvolvimento de depósitos proteicos, como os beta-amiloides ou a proteína tau.[79][80][81]
Tem sido proposto que o tipo 1 do vírus da herpes simplex desempenha um papel de causa em pessoas portadoras de versões susceptíveis do gene APOE.[82] O stress oxidativo pode também ter um papel significativo na formação da doença.[83][84][85]
As pessoas com Alzheimer revelam uma perda de 70% das células do cerúleo, as quais para além de serem neurotransmissoras, fornecem noradrenalina, um agente anti-inflamatório nos microambientes em volta dos neurónios, das células da glia, e dos vasos sanguíneos no neocórtex e no hipocampo. Demonstrou-se também que a noradrenalina estimula a micróglia de ratos a suprimir a produção de citocinas induzidas por Aβe a fagocitose de Aβ. Isto sugere que a degeneração do cerúleo pode ser responsável pelo aumento da deposição de Aβ no cérebro de pessoas com a doença.[86]
Histopatologia

A base histopatológica da doença foi descrita pela primeira vez pelo neuropatologista alemão Alois Alzheimer em 1909, que verificou a existência juntamente com placas senis (hoje identificadas como agregados de proteína beta-amilóide), de emaranhados neurofibrilares (hoje associados a mutações e consequente hiperfosforilação da proteína tau, no interior dos microtúbulos do citoesqueleto dos neurónios). Estes dois achados patológicos, num doente com severas perturbações neurocognitivas, e na ausência de evidência de compromisso ou lesão intra-vascular, permitiram a Alois Alzheimer caracterizar este quadro clínico como distinto de outras patologias orgânicas do cérebro, vindo Emil Kraepelin a dar o nome de Alzheimer à doença por ele estudada pela primeira vez, combinando os resultados histológicos com a descrição clínica.
As placas senis têm o aspecto esférico e no centro há denso acúmulo de proteína beta-amilóide A/4 que é circundada por um anel formado de partículas de neurônios anormais, células microgliais e astrócitos reactivos. Além disso, conforme os neurônios criam nós em peças essenciais de sua estrutura interna, os microtúbulos retorcidos e emaranhados prejudicam o funcionamento da rede neural. A provável causa é um defeito no cromossoma 19, responsável pela produção de uma proteína denominada apolipoproteína E4 (ApoE4).[88]
Fisiopatologia
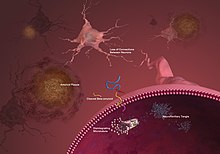
Segundo pesquisas recentes, o Alzheimer começa no tronco cerebral, mais especificamente numa área denominada núcleo dorsal da rafe, e não no córtex, que é o centro do processamento de informações e armazenamento da memória.[89]
Caracteriza-se clinicamente pela perda progressiva da memória. O cérebro de um paciente com a doença de Alzheimer, quando visto em necrópsia, apresenta uma atrofia generalizada, com perda neuronal específica em certas áreas do hipocampo, mas também em regiões parieto-occipitais e frontais. O quadro de sinais e sintomas dessa doença está associado à redução de neurotransmissores cerebrais, como acetilcolina, noradrenalina e serotonina. O tratamento para o mal de Alzheimer é sintomático e consiste justamente na tentativa de restauração da função colinérgica, noradrenérgica e serotoninérgica.[90]
A perda de memória causa a estes pacientes um grande desconforto em sua fase inicial e intermediária. Já na fase adiantada não apresentam mais condições de perceber-se doentes, por falha da autocrítica. Não se trata de uma simples falha na memória, mas sim de uma progressiva incapacidade para o trabalho e convívio social, devido a dificuldades para reconhecer pessoas próximas e objetos. Mudanças de domicílio são mal recebidas, pois tornam os sintomas mais agudos. Um paciente com doença de Alzheimer pergunta a mesma coisa centenas de vezes, mostrando sua incapacidade de fixar algo novo. Palavras são esquecidas, frases são trocadas, muitas permanecendo sem finalização.
Diagnóstico

O diagnóstico da doença de Alzheimer é geralmente baseado na observação comportamental e no historial clínico da pessoa e respetivos familiares. O diagnóstico é apoiado pela presença de características neurológicas e neuropsicológicas e pela exclusão de outras hipóteses.[91][92] A exclusão de outras patologias cerebrais ou outros subtipos de demência pode ser auxiliada por diversas técnicas de imagiologia médica, como a tomografia computadorizada (TAC), ressonância magnética (IRM), tomografia computorizada por emissão de fotão único (SPECT) ou tomografia por emissão de positrões (TEP).[93] Estas técnicas permitem ainda prever a evolução de estágios pródromos (défice cognitivo ligeiro) para a doença de Alzheimer.[94]
O estado da doença pode ser caracterizado em maior profundidade através da avaliação das funções intelectuais, entre as quais a avaliação da memória.[6] Várias organizações médicas têm vindo a criar critérios de diagnóstico com o intuito de padronizar e facilitar o processo de diagnóstico. O diagnóstico pode ser confirmado com elevado grau de precisão através de um exame histológico ao tecido cerebral após a morte.[95]
Critérios
Os critérios internacionais mais utilizados no diagnóstico de demência são os propostos pelo Manual de Diagnóstico e Estatística da Associação Americana de Psiquiatria (DSM-IV-TR). Estes critérios definem demência como o desenvolvimento de múltiplos défices cognitivos que incluem obrigatoriamente o compromisso da memória a curto prazo e pelo menos outra perturbação cognitiva, como perturbações na linguagem, incapacidade de executar determinados movimentos, incapacidade de reconhecer objetos ou pessoas ou perturbação na capacidade executiva. Os critérios determinam ainda que estes défices devem ser suficientemente graves para terem repercussão a nível funcional e que devem representar um declínio em relação a um estado anterior.[96][97]
Para o diagnóstico específico da doença de Alzheimer, os critérios mais utilizados internacionalmente são os do Manual de Diagnóstico e Estatística da Associação Americana de Psiquiatria (DSM-IV-TR, 2000) e os critérios de Alzheimer NINCDS-ADRDA, extensivamente revistos em 2007.[95][98] Os critérios NINCDS-ADRDA especificam que a presença de défices cognitivos deve ser confirmada com exames neuropsicológicos de modo a poder determinar um diagnóstico para a possível ou provável presença da doença de Alzheimer. Especificam ainda que o diagnóstico definitivo só é possível mediante uma análise histopatológica, incluindo um exame microscópico ao tecido cerebral (autópsia ou biópsia).[99] Tanto os critérios NINCDS-ADRDA como os DSM-IV-TR especificam os oito domínios cognitivos que são debilitados pela doença de Alzheimer: memória, linguagem, perceção, atenção, capacidades construtivas, orientação, resolução de problemas e capacidades funcionais.[100]
Exames

Na avaliação de défices cognitivos, uma das ferramentas mais amplamente utilizadas são os exames neuropsicológicos, como o exame breve do estado mental. No entanto, para obter resultados mais precisos é necessário um conjunto de exames, especialmente durante os estágios iniciais da doença.[101][102] Os exames neurológicos são também fundamentais no diagnóstico diferencial de Alzheimer em relação a outras doenças.[6]
No diagnóstico podem também ser realizadas entrevistas com os familiares. Os cuidadores podem fornecer informações importantes sobre as capacidades quotidianas ou sobre a diminuição das capacidades mentais da pessoa.[94] O ponto de vista do cuidador é particularmente importante, uma vez que a pessoa com Alzheimer muitas vezes não está consciente das suas próprias debilidades.[103] Em muitos casos, a própria família também tem dificuldade em se aperceber dos sintomas iniciais de demência e pode não transmitir informação precisa ao médico.[104]
Os exames complementares disponibilizam informação adicional sobre algumas características da doença e são também usados para despistar outros diagnósticos. Os exames ao sangue permitem identificar outras causas de demência que não Alzheimer,[6] causas essas que em alguns casos podem ser reversíveis.[105] É também vulgar a realização de exames à função da tiroide, à vitamina B12, à deteção de sífilis ou anemia, exames que permitam excluir problemas metabólicos, incluindo exames à função renal, níveis de eletrólitos e diabetes e ainda exames que permitam determinar a quantidade de metais pesados no organismo.[6]
Podem também ser realizados testes psicológicos para determinar a possibilidade de depressão, uma vez que esta doença pode ser concorrente com Alzheimer, um sinal precoce de défice cognitivo,[106] ou até a própria causa.[107][108]
Diagnóstico precoce
A investigação em Alzheimer tem-se debruçado no diagnóstico da condição antes dos próprios sintomas se manifestarem,[109] tendo sido desenvolvida uma série de exames bioquímicos que permitem a deteção precoce da doença. Um destes exames envolve a análise do líquido cefalorraquidiano para a presença de beta-amiloides ou proteínas tau,[110] tanto do total de proteínas como da concentração de proteínas tau181P fosforiladas.[111] Este exame proteico, realizado através de punção lombar, pode prever o aparecimento de Alzheimer com sensibilidade entre 94 e 100%.[111] Quando usado em conjunto com os exames imagiológicos, permite aos médicos identificar em pessoas com perda significativa de memória aqueles que se encontram a desenvolver a doença.[111]
Prevenção
Atualmente não existem evidências conclusivas que permitam apoiar qualquer medida em concreto para a prevenção de Alzheimer.[112][113][114][115][116] Os estudos globais de medidas para prevenir ou atrasar o desenvolvimento da doença produzem na maior parte das vezes resultados inconsistentes. Os estudos epidemiológicos têm proposto a existência de relações entre a probabilidade de desenvolver Alzheimer e determinados factores modificadores, como o tipo de dieta, o risco cardiovascular, produtos farmacêuticos ou atividades intelectuais, entre outros. No entanto, só uma investigação mais aprofundada, incluindo ensaios clínicos, é que pode confirmar se estes fatores podem ajudar a prevenir a doença.[117]
Medicamentos
Embora os fatores de risco cardiovasculares, como a hipercolesterolemia, hipertensão arterial, diabetes ou o tabagismo, estejam associados a um maior risco de vir a desenvolver Alzheimer,[118][119] as estatinas (fármacos para a diminuição do colesterol) não são eficazes na prevenção ou atraso da evolução da doença.[120][121]
O uso prolongado de anti-inflamatórios não esteroides (AINEs) está associado à diminuição da probabilidade de vir a desenvolver Alzheimer.[122] Os estudos humanos postmortem, em modelos animais ou investigação in vitro também apoiam a noção de que os AINEs são capazes de reduzir a inflamação relacionada com as placas amiloides.[122] No entanto, os ensaios clínicos que investigaram o seu uso enquanto tratamento paliativo não demonstraram resultados positivos, aparentemente porque a concentração de AINEs no cérebro após a administração oral é muito pequena.[123] A terapia de substituição hormonal, embora tenha sido usada no passado, pode aumentar o risco de demência.[124]
Estilo de vida

As pessoas que se envolvem em atividades intelectuais, como a leitura, jogos de tabuleiro, palavras cruzadas, toque de instrumentos musicais ou que têm interação social de forma regular demonstram menor risco de vir a desenvolver doença de Alzheimer.[125] Isto é consistente com a teoria da reserva cognitiva, que alega que determinadas experiências de vida levam a uma maior eficiência no funcionamento dos neurónios, o que faz com que o indivíduo seja dotado de uma reserva cognitiva que atrasa o aparecimento das manifestações de demência.[125] O nível de escolaridade atrasa o desenvolvimento do síndrome de Alzheimer, e não apresenta relação com a diminuição da esperança de vida após o diagnóstico.[126] Aprender uma segunda língua, mesmo que durante a terceira idade, aparenta atrasar o aparecimento da doença.[127] A atividade física também está associada a um menor risco de Alzheimer.[126]
Dieta
Os consumidores de dieta mediterrânica apresentam menor risco de vir a desenvolver Alzheimer,[128][129] podendo até melhorar os resultados em pessoas com a doença.[130] Por outro lado, os consumidores de dietas ricas em gorduras saturadas e hidratos de carbono simples apresentam maior risco.[131] O mecanismo de ação proposto tem sido o efeito benéfico a nível cardiovascular da dieta mediterrânica.[129] Diversos alimentos ricos em flavonoides, como o cacau, vinho tinto ou o chá, podem diminuir o risco de Alzheimer.[132][133] No entanto, há poucas evidências que sustentem que o consumo ligeiro a moderado de álcool, em particular de vinho tinto, esteja associado a um menor risco de Alzheimer.[134] Há evidências conjeturais de que a cafeína possa ser protetora.[135]
Os estudos de revisão sobre o uso de vitaminas e sais minerais não encontraram evidências consistentes suficiente que permitam a sua recomendação. Isto inclui a vitamina A,[136][137] C,[138][139] E,[139][140] selénio,[141] zinco,[142] e ácido fólico com ou sem vitamina B12.[143] Para além disso, o consumo excessivo de vitamina E está associado a outros riscos de saúde.[139] Os ensaios sobre o ácido fólico (vitamina B9) e outras vitaminas B não conseguiram demonstrar qualquer associação relevante com o declínio cognitivo.[144] Em pessoas já com Alzheimer, acrescentar à dieta ácido docosa-hexaenoico, um ácido gordo ómega 3 não mostrou atrasar o declínio da doença.[145]
A curcumina não demonstra ter qualquer benefício em seres humanos, embora haja evidências conjeturais em animais.[146] Há evidências inconsistentes e pouco convincentes de que o ginkgo tenha qualquer efeito positivo no défice cognitivo ou na demência.[147] Também não há evidências concretas de que os canabinoides sejam eficazes na melhoria dos sintomas de Alzheimer ou demência.[148] No entanto, alguma investigação em fase inicial mostra ser promissora.[149]
Tratamento

O tratamento visa minimizar os sintomas, proteger o sistema nervoso e retardar o máximo possível a evolução da doença. Os inibidores da acetilcolinesterase, atuam inibindo a enzima responsável pela degradação da acetilcolina que é produzida e liberada por algumas áreas do cérebro (como os do núcleo basal de Meynert). A deficiência de acetilcolina é considerada um dos principais fatores da doença de Alzheimer, mas não é o único evento bioquímico/fisiopatológico que ocorre. Mais recentemente, um grupo de medicações conhecido por inibidores dos receptores do tipo NMDA (N-Metil-D-Aspartato) do glutamato entrou no mercado brasileiro, já existindo no europeu há mais de uma década. Um desses medicamentos, a memantina(HEIMER 10 Mg - Eurofarma), atua inibindo a ligação do glutamato, neurotransmissor excitatório do sistema nervoso central a seus receptores. O glutamato é responsável por reações de excitotoxicidade com abertura de radicais livres e lesão tecidual e neuronal. Há uma máxima na medicina que diz que uma doença pode ser intratável, mas o paciente não.
Os medicamentos inibidores da acetil-colesterase são[151]:
Efeitos colaterais comuns desses medicamentos:
- Hepatotoxicidade (30% na Tacrina)
- Diarréia
- Náusea
- Vômitos
- Tontura
- Fadiga
- Insônia
- Falta de apetite
- Mialgia
Vários desses efeitos colaterais tendem a desaparecer nas primeiras semanas. Eles são mais eficazes no início do tratamento pois conforme o núcleo basal de Meynert vai degenerando restam cada vez menos receptores da acetilcolina. A quantidade de Apolipoproteína E e estrógeno são importantes preditores do sucesso terapêutico.[152]
Medicamentos psiquiátricos
Como a depressão e ansiedade são um problema constante no Alzheimer é comum que os médicos prescrevam antidepressivos, principalmente inibidores selectivos da recaptação da serotonina como sertralina (ASSERT e Zoloft), citalopram (Cipramil) e escitalopram (Lexapro). Porém os estudos demonstrando sua eficácia são bastante limitados, diminuindo a concentração, atenção e o estado de vigília sendo a eletroconvulsoterapia uma boa alternativa.[153] Antidepressivos além de melhorarem o humor, o apetite, o sono, o auto-controle e diminuirem a ansiedade, tendências suicidas e agressividade tem demonstrado também significativamente retardar a degeneração do cérebro.
Os medicamentos antipsicóticos, como o haloperidol (Haldol), têm sido utilizados no intuito de facilitar os cuidados com o paciente, especialmente reduzindo as alucinações, a agressividade, os distúrbios de humor, a anedonia, a apatia e a disforia, que são comportamentos que ocorrem com a evolução da patologia. O antpsicótico quetiapina tem se tornado uma boa alternativa para quadros de agitação e delírios, pois é uma droga super segura e por se tratar de um antpsicótico atípico com menor potencial de promover efeitos extrapiramidais e menor risco cardiometabólico tende a se tornar primeira escolha para tratamento desses sintomas associados as demências. Os benzodiazepínicos, como o diazepam (Valium), tem sido usado para insônia, ansiedade, agitação motora e irritabilidade, porém causando sonolência, desatenção e menor coordenação motora (ataxia) o que pode ser um sério agravante.[154]
Novos tratamentos
Estudos indicam que Anti-inflamatórios não esteroides (AINEs) podem servir como proteção contra a demência em usuários crônicos destes fármacos. A relação pode advir da observação de inúmeras substâncias pró-inflamatórias envolvidas na fisiopatologia da doença e diretamente presentes em placas neuríticas; e, emaranhados neurofibrilares, assim como pela ação direta de certos anti-inflamatórios sobre a clivagem de proteína precursora do amilóide.[155] O ibuprofeno (Advil) e a indometacina (Indocid) - mas não o naproxeno (Naprosyn), o celecoxib (Celebra) ou o ácido acetilsalicílico (Aspirina) - demonstraram reduzir os níveis de Aβ acima de 80% em cultura de células49. Como nem todos os antiinflamatórios não-esteroidais apresentaram esse efeito, acredita-se que essa redução ocorreu por um processo independente da atividade antiinflamatória sobre a COX.[156]
Em 2008 um estudo conseguiu desenvolver um meio de reverter alguns sintomas do Mal de Alzheimer em questão de minutos. Uma injeção de etanercepte (nome comercial: Enbrel) na espinha, uma citocina usada no tratamento de problemas imunológicos, atuou inibindo o fator de necrose tumoral alfa (TNF) resultando em melhoras cognitivas e comportamentais quase imediatas.[157]
Em 2011, outro estudo identificou que um defeito no fígado é responsável pelo excesso de produção de amilóide beta. Em testes com animais o uso de imatinib (nome comercial: Gleevec), uma droga usada no tratamento do câncer, resultou em diminuição de amilóides beta no sangue e no cérebro. Planejam fazer testes com humanos em breve.[158]
A estimulação profunda do cérebro está a ser alvo de estudo na universidade do Canadá com resultados encorajantes.[159]
Em julho de 2012, cientistas do colégio médico de Weill Cornell em Nova Iorque (nordeste dos Estados Unidos) apresentaram um experimento usando o fármaco imunológico Gammagard (também conhecido como imunoglobina intravenosa [160]). Este medicamento, era utilizado como imunossupressor em casos de transplantes e enfermidades do sistema imunológico. Um dos resultados do estudo demonstrou que, os pacientes (número reduzido, nessa parte do experimento) que receberam o medicamento em alta dosagem, não apresentaram deterioração cognitiva e perda de memória durante três anos. [161][162]
Terapias e abordagens comunicacionais
As intervenções psicossociais são usadas de forma complementar à terapia farmacêutica e podem ser divididas em abordagens ao comportamento, emoções, cognição ou estimulação. No entanto, a investigação disponível sobre a sua eficácia raramente é específica para Alzheimer, focando-se na demência de uma forma geral.[163]
As intervenções ao nível do comportamento tentam identificar e reduzir os antecedentes e as consequências de comportamentos problemáticos. Embora esta abordagem não demonstre eficácia em melhorar a função geral,[164] pode ajudar a diminuir problemas comportamentais específicos, como incontinência urinária.[165] Para outros problemas, como o comportamento errante, não existem ainda dados de qualidade sobre a eficácia destas técnicas.[166][167]
As intervenções de abordagem emocional incluem a terapia de reminiscência, a terapia de validação, psicoterapia de apoio, a terapia de integração sensorial e a terapia de presença simulada. Embora existam poucos ou nenhuns estudos científicos formais sobre a psicoterapia de apoio, alguns médicos consideram que tenha alguma utilidade em ajudar pessoas com défices moderados a adaptar-se à doença.[163] A terapia de reminiscência envolve a discussão de experiências passadas, individualmente ou em grupo, muitas vezes com a ajuda de fotografias, objetos domésticos, música e gravações ou qualquer objeto do passado que seja familiar ao doente. Embora haja poucos estudos de qualidade sobre a eficácia desta terapia, é possível que seja benéfica para a cognição e ânimo.[168] A terapia de presença simulada baseia-se nas teorias de vinculação e envolve a reprodução de uma gravação com as vozes dos familiares mais próximos da pessoa com Alzheimer. Existem evidências parciais de que esta terapia pode diminuir as atitudes provocadoras.[169] A terapia de validação alega que a ansiedade da pessoa pode ser reduzida caso se tente entrar na sua realidade, em vez de a tentar trazer à nossa realidade, reduzindo assim o número de conflitos, enquanto que a terapia de integração sensorial baseia-se em exercícios destinados a estimular os sentidos. No entanto, não há evidências científicas que apoiem a utilidade destas terapias.[170][171]
As intervenções de abordagem cognitiva, nas quais se inclui a terapia de orientação da realidade e terapia de reabilitação cognitiva, propõem-se a diminuir os défices cognitivos. A terapia de orientação da realidade consiste em apresentar informações sobre o tempo, local ou pessoa de modo a facilitar a compreensão do doente em relação ao que está à sua volta e ao seu lugar nela. Por outro lado, a terapia de reabilitação cognitiva tenta melhorar as capacidades debilitadas através do exercício das capacidades mentais. Ambos têm demonstrado alguma eficácia em melhorar as capacidades cognitivas,[172][173] embora em alguns dos estudos estes efeitos fossem transitórios e também tivessem sido indicados alguns efeitos negativos, como a frustração.[163]
Os tratamentos de estimulação cognitiva incluem a arte terapia, musicoterapia, terapia assistida com animais, fisioterapia ou outro tipo de atividades recreativas. Há poucas evidências que apoiem a eficácia da estimulação na melhoria do comportamento, ânimo ou funções. No entanto, embora estes efeitos sejam importantes, o principal apoio para o recurso às terapias de estimulação são as alterações positivas na rotina diária do paciente.[163]
Cuidadores

Conforme a doença avança aumentam as dificuldades para os familiares que se veem tendo que cuidar, acompanhar e ajudar no tratamento de um familiar que não mais reconhece as pessoas e depende a maior parte do tempo do auxílio de alguém, até para realizar suas necessidades fisiológicas mais básicas. Os cuidadores são fundamentais para o tratamento do idoso com Alzheimer no ambiente domiciliar, mas nem todos os familiares estão preparados física e psicologicamente para conviver e cuidar de alguém que não os reconhece nem valoriza seus esforços. Por isso é importante o acesso às informações sobre a patologia e apoio psicosocial aos cuidadores.[174] E o cuidador de paciente com Alzheimer frequentemente tem que lidar com irritabilidade, agressividade, mudanças de humor e de comportamento.
É recomendado a participação do cuidador em programas de cuidado ao idoso com Alzheimer para esclarecer dúvidas sobre a doença, acompanhar o tratamento, dar apoio psicológico e social para atenuar o esgotamento e o estresse gerados pela convivência com uma pessoa que a cada dia vai precisar de mais cuidado e atenção no ambiente domiciliar.
Os cuidadores são responsáveis pela manutenção da segurança física, redução da ansiedade e agitação, melhoria da comunicação, promoção da independência nas atividades de autocuidado, atendimento das necessidades de socialização e privacidade, manutenção da nutrição adequada, controle dos distúrbios do padrão de sono e transporte para serviços de saúde além das inúmeras atividades diárias de cuidado com o lar.[175]
Prognóstico

| Sem dados ≤ 50 50–70 70–90 90–110 110–130 130–150 | 150–170 170–190 190–210 210–230 230–250 ≥ 250 |
É difícil diagnosticar a doença de Alzheimer durante os primeiros estágios. O diagnóstico definitivo geralmente só consegue ser determinado quando o défice cognitivo compromete as realização de atividades diárias, embora a pessoa possa continuar a viver de forma independente. Os sintomas progridem desde ligeiros problemas cognitivos, como perda de memória, até estágios avançados de distúrbios cognitivos e não cognitivos que impossibilitam que o paciente viva sozinho, especialmente durante a fase final da doença.[29]
A esperança de vida da população com Alzheimer é reduzida.[10][176][177] A esperança média de vida após o diagnóstico é de aproximadamente sete anos.[10] Menos de 3% das pessoas vive para além dos quatorze anos.[11] Apesar de nos casos de Alzheimer precoce a média da esperança de vida ser superior, é bastante mais reduzida quando comparada com a generalidade da população.[177] Men have a less favourable survival prognosis than women.[11][178]
A doença é a causa de morte subjacente em 70% dos casos.[10] A pneumonia e a desidratação são as mais frequentes causas de morte imediata.[10][178] As características da doença associadas a esta reduzida sobrevivência são o agravamento do défice cognitivo, a diminuição das capacidades executoras, a ocorrência de quedas e transtornos neurológicos.[176][179][180]
Epidemiologia
As duas principais medidas usadas em estudos epidemiológicos sobre Alzheimer são a incidência e a prevalência. A incidência é o número de novos casos por cada unidade de pessoa-tempo em risco; geralmente, o número de novos casos por cada milhar de pessoas-ano. A prevalência é o número total de casos da doença em determinada população a dado momento. No que diz respeito à incidência, os estudos longitudinais Coorte (estudos onde a população sem a doença é seguida ao longo dos anos) mostram taxas de incidência entre 10 a 15 por cada mil pessoas-ano para todas as demências e entre 5-8 para os casos específicos de Alzheimer, o que significa que mais de metade de todos os novos casos anuais de demência são Alzheimer.[181][182] A idade avançada é o principal fator de risco da doença, pelo que a taxa de incidência não é igual em todas as idades: por cada cinco anos após os 65 anos, o risco de adquirir a doença duplica, em média.[181][182] Existem também diferenças entre os sexos na taxa de incidência, uma vez que as mulheres apresentam maior risco de desenvolver Alzheimer, principalmente acima dos 85 anos.[182][183] Existe uma relação inversamente proporcional entre a prevalência de demência e a escolaridade. Nos indivíduos com oito anos ou mais de escolaridade a prevalência é de 3,5%, enquanto que nos analfabetos é de 12,2%.[184]
A prevalência de Alzheimer em determinada população depende de diversos fatores, entre os quais a incidência e a taxa de sobrevivência. Uma vez que a incidência de Alzheimer aumenta com a idade, é especialmente importante considerar a média de idades da população a estudar. Em Portugal e durante o ano de 2009, a Alzheimer Europe estima que existam cerca de 153 000 pessoas com demência, das quais 90 000 com Alzheimer.[185] No Brasil, em 2009, o número total de casos era de cerca de um milhão.[186] Nos estados Unidos, segundo dados de 2000 estima-se que a prevalência seja de 1,6% no intervalo entre os 65 e 74 anos, aumentando para 19% no intervalo de 75-84 e para 42% no intervalo superior a 84 anos.[187][188] Em regiões menos desenvolvidas, as taxas de prevalência são inferiores.[189] A Organização Mundial de Saúde estima que em 2005 0,379% das pessoas em todo o mundo tivessem demência, número que aumentará para 0,441% em 2015 e para 0,556% em 2030,[190], conclusões que são confirmadas por outros estudos.[189] Outro estudo estimou que em 2006 0,4% da população mundial (intervalo entre 0,17–0,89%) fosse atingida por Alzheimer, o que corresponde a um número absoluto de 26,6 milhões (intervalo 11,4–59,4 milhões). Estima-se também que em 2050 a taxa de prevalência será três vezes superior e o número absoluto de casos quatro vezes superior.[3][191]
História

Já na Antiguidade clássica os médicos e filósofos gregos e romanos associavam a progressão da demência à idade avançada.[1] No entanto, só em 1901 é que o psiquiatra alemão Alois Alzheimer identificou pela primeira vez um caso da patologia que viria a ser denominada doença de Alzheimer, numa mulher de cinquenta anos a que chamava Auguste D. O médico seguiu a paciente até à sua morte, em 1906, data em que publicou o primeiro relatório sobre o caso.[192][193][194] Durante os cinco anos seguintes, foram reportados na literatura médica onze casos semelhantes, alguns dos quais referindo-se já à doença pelo termo Alzheimer.[1] A doença foi pela primeira vez descrita enquanto condição autónoma por Emil Kraepelin, depois de ter suprimido algumas das características clínicas (alucinações) e patológicas (alterações arterioescleróticas) do relatório original de Auguste D.[195] Kraepelin incluiu a doença de Alzheimer, também denominada por si "demência pré-senil", na oitava edição do seu Manual de Psiquiatria, publicado em 15 de julho de 1910.[196]
Durante a maior parte do século XX, o diagnóstico de Alzheimer era reservado para indivíduos entre os 45 e 65 anos de idade que desenvolviam sintomas de demência. No entanto, esta terminologia foi alterada em 1977 após numa conferência se ter concluído que as manifestações patológicas da demência senil e pré-senil eram praticamente idênticas, embora os autores também tenham acrescentado que isto não excluía a hipótese de terem diferentes causas.[197] Isto levou a que o diagnóstico de Alzheimer se tornasse independente da idade.[198] Durante algum tempo usou-se o termo "demência senil do tipo Alzheimer" para descrever a condição em pacientes com idade superior a 65 anos, enquanto que o termo "doença de Alzheimer" era usado para as pessoas com idade inferior. Eventualmente, o termo "doença de Alzheimer" foi adotado pela nomneclatura clínica para descrever indivíduos de todas as idades com um quadro de sintomas, evolução e neuropatologia em comum.[199]
Custos sociais
A demência, e especificamente a doença de Alzheimer, podem estar entre as doenças mais dispendiosas para a sociedade na Europa e nos Estados Unidos,[19][20] enquanto o seu custo em outros países, como Argentina,[200] na ou Coreia do Sul,[201] é também elevado e crescente. Estes custos irão provavelmente aumentar com a envelhecimento da sociedade, tornando-se um importante problema social. Os custos associados à doença incluem os custos médicos diretos, tais como o de enfermagem home care, custos diretos não-médicos, como acompanhantes, e os custos indiretos tais como a perda de produtividade tanto do paciente como de quem o cuida.[20] Os números variam de um para outro estudo, mas os custos de demência no mundo inteiro foram calculados em cerca de 160 bilhões de dólares,[202], enquanto os custos do mal de Alzheimer nos Estados Unidos podem ser de 100 bilhões de dólares anuais.[20]
Ver também
- Demência
- Demência vascular, doença que pode ocorrer simultaneamente
- Demência com corpos de Lewy, muitas vezes confundida com a doença de Alzheimer
- Rember
Referências
- ↑ a b c Berchtold NC, Cotman CW (1998). «Evolution in the Conceptualization of Dementia and Alzheimer's Disease: Greco-Roman Period to the 1960s». Neurobiology of Aging. 19 (3): 173–89. PMID 9661992. doi:10.1016/S0197-4580(98)00052-9 Erro de citação: Código
<ref>inválido; o nome "pmid9661992" é definido mais de uma vez com conteúdos diferentes - ↑ Brookmeyer R, Gray S, Kawas C (1998). «Projections of Alzheimer's Disease in the United States and the Public Health Impact of Delaying Disease Onset». American Journal of Public Health. 88 (9): 1337–42. PMC 1509089
 . PMID 9736873. doi:10.2105/AJPH.88.9.1337
. PMID 9736873. doi:10.2105/AJPH.88.9.1337
- ↑ a b Brookmeyer R, Johnson E, Ziegler-Graham K, Arrighi HM (2007). «Forecasting the global burden of Alzheimer's disease». Alzheimer's & Dementia. 3 (3): 186–91. PMID 19595937. doi:10.1016/j.jalz.2007.04.381. Consultado em 18 de Junho de 2008 Erro de citação: Código
<ref>inválido; o nome "Brookmeyer2007" é definido mais de uma vez com conteúdos diferentes - ↑ Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (January 2008). "Incidence and subtypes of dementia in three elderly populations of central Spain". J. Neurol. Sci. 264 (1–2): 63–72. doi:10.1016/j.jns.2007.07.021. PMID 17727890.
- ↑ «What is Alzheimer's disease?». Alzheimers.org.uk. Agosto de 2007. Consultado em 21 de Fevereiro de 2008
- ↑ a b c d e f g Waldemar G, Dubois B, Emre M, Georges J, McKeith IG, Rossor M, Scheltens P, Tariska P, Winblad B (2007). «Recommendations for the Diagnosis and Management of Alzheimer's Disease and Other Disorders Associated with Dementia: EFNS Guideline». European Journal of Neurology. 14 (1): e1–26. PMID 17222085. doi:10.1111/j.1468-1331.2006.01605.x
- ↑ «Alzheimer's diagnosis of AD». Alzheimer's Research Trust. Consultado em 29 de Fevereiro de 2008
- ↑ Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP (2005). «A 10-Item Smell Identification Scale Related to Risk for Alzheimer's Disease». Annals of Neurology. 58 (1): 155–160. PMID 15984022. doi:10.1002/ana.20533
- ↑ «About Alzheimer's Disease: Symptoms». National Institute on Aging. Consultado em 28 Dezembro de 2011
- ↑ a b c d e Mölsä PK, Marttila RJ, Rinne UK (1986). «Survival and Cause of Death in Alzheimer's Disease and Multi-Infarct Dementia». Acta Neurologica Scandinavica. 74 (2): 103–7. PMID 3776457. doi:10.1111/j.1600-0404.1986.tb04634.x
- ↑ a b c Mölsä PK, Marttila RJ, Rinne UK (1995). «Long-Term Survival and Predictors of Mortality in Alzheimer's Disease and Multi-Infarct Dementia». Acta Neurologica Scandinavica. 91 (3): 159–64. PMID 7793228
- ↑ Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (2004). «The Importance of Neuritic Plaques and Tangles to the Development and Evolution of AD». Neurology. 62 (11): 1984–9. PMID 15184601. doi:10.1212/01.WNL.0000129697.01779.0A
- ↑ «Clinical Trials. Found 1012 studies with search of: alzheimer». US National Institutes of Health. Consultado em 10 de Janeiro de 2011
- ↑ «More research needed on ways to prevent Alzheimer's, panel finds» (PDF). National Institute on Aging. 29 de Agosto de 2006. Consultado em 29 de Fevereiro de 2008
- ↑ «The MetLife study of Alzheimer's disease: The caregiving experience» (PDF). MetLife Mature Market Institute. Agosto de 2006. Consultado em 5 de Fevereiro de 2011. Cópia arquivada (PDF) em 8 de Janeiro de 2011
- ↑ Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (2007). «Systematic Review of Information and Support Interventions for Caregivers of People with Dementia». BMC Geriatrics. 7: 18. PMC 1951962
 . PMID 17662119. doi:10.1186/1471-2318-7-18
. PMID 17662119. doi:10.1186/1471-2318-7-18
- ↑ Schneider J, Murray J, Banerjee S, Mann A (1999). «EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden». International Journal of Geriatric Psychiatry. 14 (8): 651–661. PMID 10489656. doi:10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B
- ↑ Murray J, Schneider J, Banerjee S, Mann A (1999). «EUROCARE: A Cross-national Study of Co-resident Spouse Carers for People with Alzheimer's Disease: II—A Qualitative Analysis of the Experience of Caregiving». International Journal of Geriatric Psychiatry. 14 (8): 662–667. PMID 10489657. doi:10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4
- ↑ a b Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (2005). «Impact économique de la démence (English: The Economical Impact of Dementia)». Presse Médicale (em French). 34 (1): 35–41. ISSN 0755-4982. PMID 15685097 Erro de citação: Código
<ref>inválido; o nome "pmid15685097" é definido mais de uma vez com conteúdos diferentes - ↑ a b c d Meek PD, McKeithan K, Schumock GT (1998). «Economic Considerations in Alzheimer's Disease». Pharmacotherapy. 18 (2 Pt 2): 68–73; discussion 79–82. PMID 9543467 Erro de citação: Código
<ref>inválido; o nome "pmid9543467" é definido mais de uma vez com conteúdos diferentes - ↑ a b c d e f g h i j k l m n o p Consumer Reports; Drug Effectiveness Review Project (Maio de 2012). «Evaluating Prescription Drugs Used to Treat: Alzheimer's Disease Comparing Effectiveness, Safety, and Price» (PDF). Consumer Reports: 2
- ↑ American Psychiatry Association. Diagnostic and Statistical Manual of Mental Disorders 4ª ed. Washington: American Psychiatry Association. 1994
- ↑ a b c Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (2004). «Multiple Cognitive Deficits During the Transition to Alzheimer's Disease». Journal of Internal Medicine. 256 (3): 195–204. PMID 15324363. doi:10.1111/j.1365-2796.2004.01386.x
- ↑ Nygård L (2003). «Instrumental Activities of Daily Living: A Stepping-stone Towards Alzheimer's Disease Diagnosis in Subjects with Mild Cognitive Impairment?». Acta Neurologica Scandinavica. Suppl (179): 42–6. PMID 12603250. doi:10.1034/j.1600-0404.107.s179.8.x
- ↑ a b Arnáiz E, Almkvist O (2003). «Neuropsychological Features of Mild Cognitive Impairment and Preclinical Alzheimer's Disease». Acta Neurologica Scandinavica. 179: 34–41. PMID 12603249. doi:10.1034/j.1600-0404.107.s179.7.x
- ↑ Landes AM, Sperry SD, Strauss ME, Geldmacher DS (2001). «Apathy in Alzheimer's Disease». Journal of the American Geriatrics Society. 49 (12): 1700–7. PMID 11844006. doi:10.1046/j.1532-5415.2001.49282.x
- ↑ Murray ED, Buttner N, Price BH (2012). «Depression and Psychosis in Neurological Practice». In: Bradley WG, Daroff RB, Fenichel GM, Jankovic J. Bradley's neurology in clinical practice. 6ª ed. Filadélfia: Elsevier/Saunders. ISBN 1-4377-0434-4
- ↑ Petersen RC (2007). «The Current Status of Mild Cognitive Impairment—What Do We Tell Our Patients?». Nature Clinical Practice. Neurology. 3 (2): 60–1. PMID 17279076. doi:10.1038/ncpneuro0402
- ↑ a b c d e f g h i j k l m n o p q r Förstl H, Kurz A (1999). «Clinical Features of Alzheimer's Disease». European Archives of Psychiatry and Clinical Neuroscience. 249 (6): 288–290. PMID 10653284. doi:10.1007/s004060050101
- ↑ Carlesimo GA, Oscar-Berman M (1992). «Memory Deficits in Alzheimer's Patients: A Comprehensive Review». Neuropsychology Review. 3 (2): 119–69. PMID 1300219. doi:10.1007/BF01108841
- ↑ Jelicic M, Bonebakker AE, Bonke B (1995). «Implicit Memory Performance of Patients with Alzheimer's Disease: A Brief Review». International Psychogeriatrics. 7 (3): 385–392. PMID 8821346. doi:10.1017/S1041610295002134
- ↑ a b Taler V, Phillips NA (Julho de 2008). «Language Performance in Alzheimer's Disease and Mild Cognitive Impairment: a comparative review». Journal of Clinical and Experimental Neuropsychology. 30 (5). PMID 18569251. doi:10.1080/13803390701550128 Parâmetro desconhecido
|péginas=ignorado (ajuda) - ↑ a b c Frank EM (1994). «Effect of Alzheimer's Disease on Communication Function». Journal of the South Carolina Medical Association. 90 (9): 417–23. PMID 7967534
- ↑ Gold DP, Reis MF, Markiewicz D, Andres D (1995). «When Home Caregiving Ends: A Longitudinal Study of Outcomes for Caregivers of Relatives with Dementia». Journal of the American Geriatrics Society. 43 (1): 10–6. PMID 7806732
- ↑ «What We Know Today About Alzheimer's Disease». Alzheimer's Association. Consultado em 1 de outubro de 2011.
While scientists know Alzheimer's disease involves progressive brain cell failure, the reason cells fail isn't clear.
- ↑ Wilson RS, Barral S, Lee JH, Leurgans SE, Foroud TM, Sweet RA, Graff-Radford N, Bird TD, Mayeux R, Bennett DA (2011). «Heritability of different forms of memory in the Late Onset Alzheimer's Disease Family Study.». J Alzheimers Dis. 23 (2): 249-55. PMID 20930268. doi:doi:10.3233/JAD-2010-101515 Verifique
|doi=(ajuda) - ↑ Gatz M, Reynolds CA, Fratiglioni L, Johansson B, Mortimer JA, Berg S, Fiske A, Pedersen NL (2006). «Role of genes and environments for explaining Alzheimer disease». Arch Gen Psychiatry. 63 (2): 168-74. PMID 16461860. doi:doi:10.1001/archpsyc.63.2.168 Verifique
|doi=(ajuda) - ↑ a b Blennow K, de Leon MJ, Zetterberg H (2006). «Alzheimer's Disease». Lancet. 368 (9533): 387–403. PMID 16876668. doi:10.1016/S0140-6736(06)69113-7
- ↑ Waring SC, Rosenberg RN (2008). «Genome-wide association studies in Alzheimer disease». Archives of Neurology. 65 (3): 329–34. PMID 18332245. doi:10.1001/archneur.65.3.329
- ↑ a b Selkoe DJ (1999). «Translating cell biology into therapeutic advances in Alzheimer's disease». Nature. 399 (6738 Suppl): A23–31. PMID 10392577. doi:10.1038/19866 Erro de citação: Código
<ref>inválido; o nome "pmid8938131" é definido mais de uma vez com conteúdos diferentes - ↑ Shioi J, Georgakopoulos A, Mehta P, Kouchi Z, Litterst CM, Baki L, Robakis NK (2007). «FAD mutants unable to increase neurotoxic Aβ 42 suggest that mutation effects on neurodegeneration may be independent of effects on Abeta». Journal of Neurochemistry. 101 (3): 674–81. PMID 17254019. doi:10.1111/j.1471-4159.2006.04391.x
- ↑ Jonsson T, Atwal JK, Steinberg S, Snaedal J, Jonsson PV, Bjornsson S, Stefansson H, Sulem P, Gudbjartsson D, Maloney J, Hoyte K, Gustafson A, Liu Y, Lu Y, Bhangale T, Graham RR, Huttenlocher J, Bjornsdottir G, Andreassen OA, Jönsson EG, Palotie A, Behrens TW, Magnusson OT, Kong A, Thorsteinsdottir U, Watts RJ, Stefansson K (2 de agosto de 2012). «A mutation in APP protects against Alzheimer's disease and age-related cognitive decline.». Nature. 488 (7409): 96–9. PMID 22801501. doi:10.1038/nature11283
- ↑ Strittmatter WJ, Saunders AM, Schmechel D, Pericak-Vance M, Enghild J, Salvesen GS, Roses AD (1993). «Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease». Proceedings of the National Academy of Sciences of the United States of America. 90 (5): 1977–81. PMC 46003
 . PMID 8446617. doi:10.1073/pnas.90.5.1977
. PMID 8446617. doi:10.1073/pnas.90.5.1977
- ↑ a b Mahley RW, Weisgraber KH, Huang Y (2006). «Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease». Proceedings of the National Academy of Sciences of the United States of America. 103 (15): 5644–51. PMC 1414631
 . PMID 16567625. doi:10.1073/pnas.0600549103
. PMID 16567625. doi:10.1073/pnas.0600549103
- ↑ Hall K, Murrell J, Ogunniyi A, Deeg M, Baiyewu O, Gao S, Gureje O, Dickens J, Evans R, Smith-Gamble V, Unverzagt FW, Shen J, Hendrie H (2006). «Cholesterol, APOE genotype, and Alzheimer disease: an epidemiologic study of Nigerian Yoruba». Neurology. 66 (2): 223–227. PMC 2860622
 . PMID 16434658. doi:10.1212/01.wnl.0000194507.39504.17
. PMID 16434658. doi:10.1212/01.wnl.0000194507.39504.17
- ↑ Gureje O, Ogunniyi A, Baiyewu O, Price B, Unverzagt FW, Evans RM, Smith-Gamble V, Lane KA, Gao S, Hall KS, Hendrie HC, Murrell JR (2006). «APOE ε4 is not associated with Alzheimer's disease in elderly Nigerians». Annals of Neurology. 59 (1): 182–185. PMC 2855121
 . PMID 16278853. doi:10.1002/ana.20694
. PMID 16278853. doi:10.1002/ana.20694
- ↑ Jonsson T, Stefansson H, Steinberg S, Jonsdottir I, Jonsson PV, Snaedal J, Bjornsson S, Huttenlocher J, Levey AI, Lah JJ, Rujescu D, Hampel H, Giegling I, Andreassen OA, Engedal K, Ulstein I, Djurovic S, Ibrahim-Verbaas C, Hofman A, Ikram MA, van Duijn CM, Thorsteinsdottir U, Kong A, Stefansson K (2012). «Variant of TREM2 associated with the risk of Alzheimer's disease». The New England Journal of Medicine (Original article). 368 (2): 107–16. PMC 3677583
 . PMID 23150908. doi:10.1056/NEJMoa1211103
. PMID 23150908. doi:10.1056/NEJMoa1211103
- ↑ Guerreiro R, Wojtas A, Bras J, Carrasquillo M, Rogaeva E, Majounie E, Cruchaga C, Sassi C, Kauwe JS, Younkin S, Hazrati L, Collinge J, Pocock J, Lashley T, Williams J, Lambert JC, Amouyel P, Goate A, Rademakers R, Morgan K, Powell J, St George-Hyslop P, Singleton A, Hardy J (2012). «TREM2 variants in Alzheimer's disease». The New England Journal of Medicine (Original article). 368 (2): 117–27. PMC 3631573
 . PMID 23150934. doi:10.1056/NEJMoa1211851
. PMID 23150934. doi:10.1056/NEJMoa1211851
- ↑ Lambert, JC (Dec 2013). «Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease.». Nature Genetics. 45 (12): 1452–8. PMC 3896259
 . PMID 24162737. doi:10.1038/ng.2802 Verifique data em:
. PMID 24162737. doi:10.1038/ng.2802 Verifique data em: |data=(ajuda) - ↑ Francis PT, Palmer AM, Snape M, Wilcock GK (1999). «The Cholinergic Hypothesis of Alzheimer's Disease: a Review of Progress». Journal of Neurology, Neurosurgery, and Psychiatry. 66 (2): 137–47. PMC 1736202
 . PMID 10071091. doi:10.1136/jnnp.66.2.137
. PMID 10071091. doi:10.1136/jnnp.66.2.137
- ↑ Shen ZX (2004). «Brain Cholinesterases: II. The Molecular and Cellular Basis of Alzheimer's Disease». Medical Hypotheses. 63 (2): 308–21. PMID 15236795. doi:10.1016/j.mehy.2004.02.031
- ↑ Wenk GL (2003). «Neuropathologic Changes in Alzheimer's Disease». The Journal of Clinical Psychiatry. 64 Suppl 9: 7–10. PMID 12934968
- ↑ Hardy J, Allsop D (1991). «Amyloid Deposition as the Central Event in the Aetiology of Alzheimer's Disease». Trends in Pharmacological Sciences. 12 (10): 383–88. PMID 1763432. doi:10.1016/0165-6147(91)90609-V
- ↑ a b Mudher A, Lovestone S (2002). «Alzheimer's disease-do tauists and baptists finally shake hands?». Trends in Neurosciences. 25 (1): 22–26. PMID 11801334. doi:10.1016/S0166-2236(00)02031-2
- ↑ Nistor M, Don M, Parekh M, Sarsoza F, Goodus M, Lopez GE, Kawas C, Leverenz J, Doran E, Lott IT, Hill M, Head E (2007). «Alpha- and Beta-secretase Activity as a Function of Age and Beta-amyloid in Down Syndrome and Normal Brain». Neurobiology of Aging. 28 (10): 1493–1506. PMC 3375834
 . PMID 16904243. doi:10.1016/j.neurobiolaging.2006.06.023
. PMID 16904243. doi:10.1016/j.neurobiolaging.2006.06.023
- ↑ Lott IT, Head E (2005). «Alzheimer Disease and Down Syndrome: Factors in Pathogenesis». Neurobiology of Aging. 26 (3): 383–89. PMID 15639317. doi:10.1016/j.neurobiolaging.2004.08.005
- ↑ Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, Niinistö L, Halonen P, Kontula K (1995). «Apolipoprotein E, Dementia, and Cortical Deposition of Beta-amyloid Protein». The New England Journal of Medicine. 333 (19): 1242–47. PMID 7566000. doi:10.1056/NEJM199511093331902
- ↑ Games D, Adams D, Alessandrini R, Barbour R, Berthelette P, Blackwell C, Carr T, Clemens J, Donaldson T, Gillespie F (1995). «Alzheimer-type Neuropathology in Transgenic Mice Overexpressing V717F Beta-amyloid Precursor Protein». Nature. 373 (6514): 523–27. PMID 7845465. doi:10.1038/373523a0
- ↑ Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (1996). «Comparison of Neurodegenerative Pathology in Transgenic Mice Overexpressing V717F Beta-amyloid Precursor Protein and Alzheimer's Disease». The Journal of Neuroscience. 16 (18): 5795–811. PMID 8795633
- ↑ Hsiao K, Chapman P, Nilsen S, Eckman C, Harigaya Y, Younkin S, Yang F, Cole G (1996). «Correlative Memory Deficits, Abeta Elevation, and Amyloid Plaques in Transgenic Mice». Science. 274 (5284): 99–102. PMID 8810256. doi:10.1126/science.274.5284.99
- ↑ Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C (2002). «Spatial Learning, Exploration, Anxiety, and Motor Coordination in Female APP23 Transgenic Mice with the Swedish Mutation». Brain Research. 956 (1): 36–44. PMID 12426044. doi:10.1016/S0006-8993(02)03476-5
- ↑ Holmes C, Boche D, Wilkinson D, Yadegarfar G, Hopkins V, Bayer A, Jones RW, Bullock R, Love S, Neal JW, Zotova E, Nicoll JA (2008). «Long-term Effects of Abeta42 Immunisation in Alzheimer's Disease: Follow-up of a Randomised, Placebo-controlled Phase I Trial». Lancet. 372 (9634): 216–23. PMID 18640458. doi:10.1016/S0140-6736(08)61075-2
- ↑ Lacor PN, Buniel MC, Furlow PW, Clemente AS, Velasco PT, Wood M, Viola KL, Klein WL (2007). «Aß Oligomer-Induced Aberrations in Synapse Composition, Shape, and Density Provide a Molecular Basis for Loss of Connectivity in Alzheimer's Disease». The Journal of Neuroscience. 27 (4): 796–807. PMID 17251419. doi:10.1523/JNEUROSCI.3501-06.2007
- ↑ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (2009). «Cellular Prion Protein Mediates Impairment of Synaptic Plasticity by Amyloid-β Oligomers». Nature. 457 (7233): 1128–32. PMC 2748841
 . PMID 19242475. doi:10.1038/nature07761
. PMID 19242475. doi:10.1038/nature07761
- ↑ Nikolaev A, McLaughlin T, O'Leary DD, Tessier-Lavigne M (19 February 2009). «APP Binds DR6 to Cause Axon Pruning and Neuron Death via Distinct Caspases». Nature. 457 (7232): 981–989. ISSN 0028-0836. PMC 2677572
 . PMID 19225519. doi:10.1038/nature07767 Verifique data em:
. PMID 19225519. doi:10.1038/nature07767 Verifique data em: |data=(ajuda) - ↑ Goedert M, Spillantini MG, Crowther RA (1991). «Tau Proteins and Neurofibrillary Degeneration». Brain Pathology (Zurich, Switzerland). 1 (4): 279–86. PMID 1669718. doi:10.1111/j.1750-3639.1991.tb00671.x
- ↑ Iqbal K, Alonso Adel C, Chen S, Chohan MO, El-Akkad E, Gong CX, Khatoon S, Li B, Liu F, Rahman A, Tanimukai H, Grundke-Iqbal I (2005). «Tau Pathology in Alzheimer Disease and Other Tauopathies». Biochimica Et Biophysica Acta. 1739 (2–3): 198–210. PMID 15615638. doi:10.1016/j.bbadis.2004.09.008
- ↑ Chun W, Johnson GV (2007). «The Role of Tau Phosphorylation and Cleavage in Neuronal Cell Death». Frontiers in Bioscience: A Journal and Virtual Library. 12: 733–56. PMID 17127334. doi:10.2741/2097
- ↑ Xu H, Finkelstein DI, Adlard PA (2014 Jun 12). «Interactions of metals and Apolipoprotein E in Alzheimer's disease». Front Aging Neurosci. 6. 121 páginas. PMC 4054654
 . PMID 24971061. doi:10.3389/fnagi.2014.00121.
. PMID 24971061. doi:10.3389/fnagi.2014.00121. Although we still do not know if the metal ion dyshomeostasis present in AD is a cause or consequence of the disease, there is a growing body of evidence showing a direct correlation between metal ions and key AD-related key proteins.
Verifique data em:|data=(ajuda) - ↑ Shcherbatykh I, Carpenter DO (2007). «The Role of Metals in the Etiology of Alzheimer's Disease». Journal of Alzheimer's Disease. 11 (2): 191–205. PMID 17522444
- ↑ Santibáñez M, Bolumar F, García AM (2007). «Occupational Risk Factors in Alzheimer's Disease: A Review Assessing the Quality of Published Epidemiological Studies». Occupational and Environmental Medicine. 64 (11): 723–732. PMC 2078415
 . PMID 17525096. doi:10.1136/oem.2006.028209
. PMID 17525096. doi:10.1136/oem.2006.028209
- ↑ Rondeau V (2002). «A Review of Epidemiologic Studies on Aluminum and Silica in Relation to Alzheimer's Disease and Associated Disorders». Reviews on Environmental Health. 17 (2): 107–21. PMID 12222737. doi:10.1515/REVEH.2002.17.2.107
- ↑ Brewer GJ (March 2012). «Copper excess, zinc deficiency, and cognition loss in Alzheimer's disease». BioFactors (Oxford, England). 38 (2): 107–113. PMID 22438177. doi:10.1002/biof.1005 Verifique data em:
|data=(ajuda) - ↑ Kheifets L, Bowman JD, Checkoway H, Feychting M, Harrington JM, Kavet R, Marsh G, Mezei G, Renew DC, van Wijngaarden E (Fevereiro de 2009). «Future needs of occupational epidemiology of extremely low frequency electric and magnetic fields: review and recommendations». Occupational and Environmental Medicine. 66 (2): 72–80. PMID 18805878. doi:10.1136/oem.2007.037994
- ↑ Scientific Committee on Emerging and Newly Identified Health Risks-SCENIHR (Janeiro de 2009). «Health Effects of Exposure to EMF» (PDF). Brussels: Directorate General for Health&Consumers; European Commission: 4–5
- ↑ Cataldo JK, Prochaska JJ, Glantz SA (2010). «Cigarette smoking is a risk factor for Alzheimer's disease: An analysis controlling for tobacco industry affiliation». Journal of Alzheimer's Disease. 19 (2): 465–80. PMC 2906761
 . PMID 20110594. doi:10.3233/JAD-2010-1240
. PMID 20110594. doi:10.3233/JAD-2010-1240
- ↑ Eikelenboom P, van Exel E, Hoozemans JJ, Veerhuis R, Rozemuller AJ, van Gool WA (2010). «Neuroinflammation – An Early Event in Both the History and Pathogenesis of Alzheimer's Disease». Neuro-Degenerative Diseases. 7 (1–3): 38–41. PMID 20160456. doi:10.1159/000283480
- ↑ Moulton PV, Yang W (2012). «Air Pollution, Oxidative Stress, and Alzheimer's Disease». Journal of Environmental and Public Health. 2012. 472751 páginas. PMID 22523504. doi:10.1155/2012/472751
- ↑ Bartzokis G (Agosto de 2011). «Alzheimer's Disease as Homeostatic Responses to Age-related Myelin Breakdown». Neurobiology of Aging. 32 (8): 1341–71. PMC 3128664
 . PMID 19775776. doi:10.1016/j.neurobiolaging.2009.08.007
. PMID 19775776. doi:10.1016/j.neurobiolaging.2009.08.007
- ↑ Bartzokis G, Lu PH, Mintz J (Dezembro de 2004). «Quantifying Age-Related Myelin Breakdown with MRI: Novel Therapeutic Targets for Preventing Cognitive Decline and Alzheimer's Disease». Journal of Alzheimer's Disease. 6 (6 Suppl): S53–9. PMID 15665415
- ↑ Bartzokis G, Lu PH, Mintz J (April 2007). «Human Brain Myelination and Beta-amyloid Deposition in Alzheimer's Disease». Alzheimer's & Dementia. 3 (2): 122–5. PMC 2442864
 . PMID 18596894. doi:10.1016/j.jalz.2007.01.019 Verifique data em:
. PMID 18596894. doi:10.1016/j.jalz.2007.01.019 Verifique data em: |data=(ajuda) - ↑ Itzhaki RF, Wozniak MA (2008). «Herpes Simplex Virus Type 1 in Alzheimer's Disease: The Enemy Within». Journal of Alzheimer's Disease. 13 (4): 393–405. ISSN 1387-2877. PMID 18487848
- ↑ Su B, Wang X, Nunomura A, Moreira PI, Lee HG, Perry G, Smith MA, Zhu X (Dezembro de 2008). «Oxidative Stress Signaling in Alzheimer's Disease». Current Alzheimer Research. 5 (6): 525–32. PMC 2780015
 . PMID 19075578. doi:10.2174/156720508786898451
. PMID 19075578. doi:10.2174/156720508786898451
- ↑ Kastenholz B, Garfin DE, Horst J, Nagel KA (2009). «Plant Metal Chaperones: A Novel Perspective in Dementia Therapy». Amyloid: The International Journal of Experimental and Clinical Investigation: The Official Journal of the International Society of Amyloidosis. 16 (2): 81–3. PMID 20536399. doi:10.1080/13506120902879392
- ↑ Pohanka M (2013). «Alzheimer´s Disease and Oxidative Stress: A Review». Current Medicinal Chemistry (Review). 21 (3): 356–64. PMID 24059239. doi:10.2174/09298673113206660258
- ↑ Heneka MT, Nadrigny F, Regen T, Martinez-Hernandez A, Dumitrescu-Ozimek L, Terwel D, Jardanhazi-Kurutz D, Walter J, Kirchhoff F, Hanisch UK, Kummer MP. (2010). «Locus ceruleus controls Alzheimer's disease pathology by modulating microglial functions through norepinephrine» (PDF). Proceedings of the National Academy of Sciences of the United States of America. 107: 6058–6063. PMID 20231476. doi:10.1073/pnas.0909586107
- ↑ http://www.nead.unama.br/site/bibdigital/pdf/artigos_revistas/114.pdf
- ↑ SILVA, Carlos Eduardo Lins da. O retrato do mal antes da hora. Super interessante. Set. 1997. Disponível: www.alzheimer-net.hpg.com.br.
- ↑ http://www.santoandre.sp.gov.br/biblioteca/bv/hemdig_txt/081113014.pdf
- ↑ Bryne, G. J. A.; Aust. J. Hosp. Pharm. 1998, 28, 261.
- ↑ Mendez MF (2006). «The Accurate Diagnosis of Early-onset Dementia». International Journal of Psychiatry in Medicine. 36 (4): 401–412. PMID 17407994. doi:10.2190/Q6J4-R143-P630-KW41
- ↑ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J. Therapeutic Approaches to Alzheimer's Disease. Brain. 2006;129(Pt 11):2840–55. doi:10.1093/brain/awl280. PMID 17018549.
- ↑ Dementia: Quick Reference Guide (PDF). London: National Institute for Health and Clinical Excellence. Novembro de 2006. ISBN 1-84629-312-X. Cópia arquivada (PDF) em 27 de fevereiro de 2008
- ↑ a b Schroeter ML, Stein T, Maslowski N, Neumann J (2009). «Neural Correlates of Alzheimer's Disease and Mild Cognitive Impairment: A Systematic and Quantitative Meta-Analysis involving 1,351 Patients». NeuroImage. 47 (4): 1196–1206. PMC 2730171
 . PMID 19463961. doi:10.1016/j.neuroimage.2009.05.037 Erro de citação: Código
. PMID 19463961. doi:10.1016/j.neuroimage.2009.05.037 Erro de citação: Código <ref>inválido; o nome "pmid16327345" é definido mais de uma vez com conteúdos diferentes - ↑ a b McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (1984). «Clinical Diagnosis of Alzheimer's Disease: Report of the NINCDS-ADRDA Work Group under the Auspices of Department of Health and Human Services Task Force on Alzheimer's Disease». Neurology. 34 (7): 939–44. PMID 6610841. doi:10.1212/wnl.34.7.939
- ↑ Abordagem Terapêutica das Alterações Cognitivas. Norma nº 053/2011 de 27/12/2011. [S.l.]: Direcção-Geral da Saúde. 2011. pp. 3–4
- ↑ Ricardo Nitrini; Paulo Caramelli; Cássio Machado de Campos Bottino; Benito Pereira Damasceno; Sonia Maria Dozzi Brucki; Renato Anghinah (2005). «Diagnóstico de doença de Alzheimer no Brasil: critérios diagnósticos e exames complementares.». Recomendações do Departamento Científico de Neurologia Cognitiva e do Envelhecimento da Academia Brasileira de Neurologia. Arq. Neuro-Psiquiatr. 63 (3a). doi:10.1590/S0004-282X2005000400033
- ↑ Dubois B, Feldman HH, Jacova C, Dekosky ST, Barberger-Gateau P, Cummings J, Delacourte A, Galasko D, Gauthier S, Jicha G, Meguro K, O'brien J, Pasquier F, Robert P, Rossor M, Salloway S, Stern Y, Visser PJ, Scheltens P (2007). «Research Criteria for the Diagnosis of Alzheimer's Disease: Revising the NINCDS-ADRDA Criteria». Lancet Neurology. 6 (8): 734–46. PMID 17616482. doi:10.1016/S1474-4422(07)70178-3
- ↑ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (1994). «Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative». Archives of Neurology. 51 (12): 1198–204. PMID 7986174. doi:10.1001/archneur.1994.00540240042014
- ↑ American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders: DSM-IV-TR 4ª ed. Washington: American Psychiatric Association. ISBN 0-89042-025-4
- ↑ Tombaugh TN, McIntyre NJ (1992). «The mini-mental state examination: a comprehensive review». Journal of the American Geriatrics Society. 40 (9): 922–35. PMID 1512391
- ↑ Pasquier F (1999). «Early diagnosis of dementia: neuropsychology». Journal of Neurology. 246 (1): 6–15. PMID 9987708. doi:10.1007/s004150050299
- ↑ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). «Awareness of Deficits and Anosognosia in Alzheimer's Disease.». L'Encéphale (em French). 30 (6): 570–7. PMID 15738860. doi:10.1016/S0013-7006(04)95472-3
- ↑ Cruz VT, Pais J, Teixeira A, Nunes B (2004). «The Initial Symptoms of Alzheimer Disease: Caregiver Perception». Acta Médica Portuguesa (em Portuguese). 17 (6): 435–44. PMID 16197855
- ↑ Clarfield AM (2003). «The Decreasing Prevalence of Reversible Dementias: An Updated Meta-analysis». Archives of Internal Medicine. 163 (18): 2219–29. PMID 14557220. doi:10.1001/archinte.163.18.2219
- ↑ Sun X, Steffens DC, Au R, Folstein M, Summergrad P, Yee J, Rosenberg I, Mwamburi DM, Qiu WQ (2008). «Amyloid-Associated Depression: A Prodromal Depression of Alzheimer Disease?». Archives of General Psychiatry. 65 (5): 542–550. PMC 3042807
 . PMID 18458206. doi:10.1001/archpsyc.65.5.542
. PMID 18458206. doi:10.1001/archpsyc.65.5.542
- ↑ Geldmacher DS, Whitehouse PJ (1997). «Differential Diagnosis of Alzheimer's Disease». Neurology. 48 (5 Suppl 6): S2–9. PMID 9153154
- ↑ Potter GG, Steffens DC. Contribution of Depression to Cognitive Impairment and Dementia in Older adults. The Neurologist. 2007;13(3):105–17. doi:10.1097/01.nrl.0000252947.15389.a9. PMID 17495754.
- ↑ Chong MS, Sahadevan S. Preclinical Alzheimer's disease: diagnosis and prediction of progression.. Lancet Neurology. 1 de setembro de 2005;4(9):576–9. doi:10.1016/s1474-4422(05)70168-x. PMID 16109364.
- ↑ Marksteiner J, Hinterhuber H, Humpel C (2007). «Cerebrospinal Fluid Biomarkers for Diagnosis of Alzheimer's Disease: Beta-amyloid(1–42), Tau, Phospho-tau-181 and Total Protein». Drugs of Today. 43 (6): 423–31. PMID 17612711. doi:10.1358/dot.2007.43.6.1067341
- ↑ a b c De Meyer G, Shapiro F, Vanderstichele H, Vanmechelen E, Engelborghs S, De Deyn PP, Coart E, Hansson O, Minthon L, Zetterberg H, Blennow K, Shaw L, Trojanowski JQ (2010). «Diagnosis-Independent Alzheimer Disease Biomarker Signature in Cognitively Normal Elderly People». Archives of Neurology. 67 (8): 949–56. PMC 2963067
 . PMID 20697045. doi:10.1001/archneurol.2010.179
. PMID 20697045. doi:10.1001/archneurol.2010.179
- ↑ Kawas CH (2006). «Medications and Diet: Protective Factors for AD?». Alzheimer Disease and Associated Disorders. 20 (3 Supl. 2): S89–96. PMID 16917203
- ↑ Luchsinger JA, Mayeux R (2004). «Dietary Factors and Alzheimer's Disease». Lancet Neurology. 3 (10): 579–87. PMID 15380154. doi:10.1016/S1474-4422(04)00878-6
- ↑ Luchsinger JA, Noble JM, Scarmeas N (2007). «Diet and Alzheimer's Disease». Current Neurology and Neuroscience Reports. 7 (5): 366–72. PMID 17764625. doi:10.1007/s11910-007-0057-8
- ↑ «Independent Panel Finds Insufficient Evidence to Support Preventive Measures for Alzheimer's Disease». National Institutes of Health. 28 de abril de 2010
- ↑ Daviglus ML; et al. (26–28 de abril de 2010). «NIH State-of-the-Science Conference: Preventing Alzheimer's Disease and Cognitive Decline»
- ↑ Szekely CA, Breitner JC, Zandi PP (2007). «Prevention of Alzheimer's Disease». International Review of Psychiatry. 19 (6): 693–706. PMID 18092245. doi:10.1080/09540260701797944
- ↑ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (2008). «Diagnosis and Treatment of Dementia: 1. Risk Assessment and Primary Prevention of Alzheimer Disease». Canadian Medical Association Journal. 178 (5): 548–56. PMC 2244657
 . PMID 18299540. doi:10.1503/cmaj.070796
. PMID 18299540. doi:10.1503/cmaj.070796
- ↑ Rosendorff C, Beeri MS, Silverman JM (2007). «Cardiovascular Risk Factors for Alzheimer's Disease». The American Journal of Geriatric Cardiology. 16 (3): 143–9. PMID 17483665. doi:10.1111/j.1076-7460.2007.06696.x
- ↑ Reiss AB, Wirkowski E (2007). «Role of HMG-CoA Reductase Inhibitors in Neurological Disorders: Progress to Date». Drugs. 67 (15): 2111–20. PMID 17927279. doi:10.2165/00003495-200767150-00001
- ↑ Kuller LH (2007). «Statins and Dementia». Current Atherosclerosis Reports. 9 (2): 154–61. PMID 17877925. doi:10.1007/s11883-007-0012-9
- ↑ a b Szekely CA, Town T, Zandi PP (2007). «NSAIDs for the Chemoprevention of Alzheimer's Disease». Sub-Cellular Biochemistry. Subcellular Biochemistry. 42: 229–48. ISBN 978-1-4020-5687-1. PMID 17612054. doi:10.1007/1-4020-5688-5_11
- ↑ Lehrer S. (2014). «Nasal NSAIDs for Alzheimer's Disease». Am J Alzheimers Dis Other Demen. PMID 24413537
- ↑ Marjoribanks J, Farquhar C, Roberts H, Lethaby A (2012). Farquhar, Cindy, ed. «Long term hormone therapy for perimenopausal and postmenopausal women». 7: CD004143. PMID 22786488. doi:10.1002/14651858.CD004143.pub4 Parâmetro desconhecido
|joornal=ignorado (ajuda) - ↑ a b Stern Y (Julho de 2006). «Cognitive reserve and Alzheimer disease». Alzheimer Disease and Associated Disorders. 20 (2): 112–117. ISSN 0893-0341. PMID 16917199. doi:10.1097/01.wad.0000213815.20177.19
- ↑ a b Paradise M, Cooper C, Livingston G (2009). «Systematic Review of the Effect of Education on Survival in Alzheimer's Disease». International Psychogeriatrics. 21 (1): 25–32. PMID 19026089. doi:10.1017/S1041610208008053
- ↑ Predefinição:CItar periódico
- ↑ Sofi F, Macchi C, Abbate R, Gensini GF, Casini A (2010). «Effectiveness of the Mediterranean diet: can it help delay or prevent Alzheimer's disease?». Journal of Alzheimer's Disease. 20 (3): 795–801. PMID 20182044. doi:10.3233/JAD-2010-1418
- ↑ a b Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F (2008). «Lifestyle-related Factors in Predementia and Dementia Syndromes». Expert Review of Neurotherapeutics. 8 (1): 133–58. PMID 18088206. doi:10.1586/14737175.8.1.133
- ↑ Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A (Maio de 2011). «Diet and Alzheimer's disease risk factors or prevention: the current evidence.». Expert Review of Neurotherapeutics. 11 (5): 677–708. PMID 21539488. doi:10.1586/ern.11.56
- ↑ Kanoski SE, Davidson TL (18 de abril de 2011). «Western diet consumption and cognitive impairment: links to hippocampal dysfunction and obesity». Physiology & Behavior. 103 (1): 59–68. PMC 3056912
 . PMID 21167850. doi:10.1016/j.physbeh.2010.12.003
. PMID 21167850. doi:10.1016/j.physbeh.2010.12.003
- ↑ Nehlig A (Julho de 2012). «The neuroprotective effects of cocoa flavanol and its influence on cognitive performance». British Journal of Clinical Pharmacology. 75 (3). PMID 22775434. doi:10.1111/j.1365-2125.2012.04378.x
- ↑ Stoclet JC, Schini-Kerth V (Março de 2011). «Dietary flavonoids and human health». Annales Pharmaceutiques Françaises. 69 (2): 78–90. PMID 21440100. doi:10.1016/j.pharma.2010.11.004
- ↑ Panza F, Capurso C, D'Introno A, Colacicco AM, Frisardi V, Lorusso M, Santamato A, Seripa D, Pilotto A, Scafato E, Vendemiale G, Capurso A, Solfrizzi V (Maio de 2009). «Alcohol Drinking, Cognitive Functions in Older Age, Predementia, and Dementia Syndromes». Journal of Alzheimer's Disease. 17 (1): 7–31. PMID 19494429. doi:10.3233/JAD-2009-1009
- ↑ Santos C, Costa J, Santos J, Vaz-Carneiro A, Lunet N (2010). «Caffeine intake and dementia: systematic review and meta-analysis». Journal of Alzheimer's Disease. 20 Supl 1: S187–204. PMID 20182026. doi:10.3233/JAD-2010-091387
- ↑ Ono K, Yamada M (Abril de 2012). «Vitamin A and Alzheimer's disease». Geriatrics & Gerontology International. 12 (2): 180–8. PMID 22221326. doi:10.1111/j.1447-0594.2011.00786.x
- ↑ Lerner AJ, Gustaw-Rothenberg K, Smyth S, Casadesus G (Mar–Abr 2012). «Retinoids for treatment of Alzheimer's disease.». BioFactors. 38 (2): 84–9. PMID 22419567. doi:10.1002/biof.196
- ↑ Heo JH, Lee KM (Março de 2013). «The possible role of antioxidant vitamin C in Alzheimer's disease treatment and prevention». American Journal of Alzheimer's Disease and Other Dementias. 28 (2): 120–5. PMID 23307795. doi:10.1177/1533317512473193
- ↑ a b c Boothby LA, Doering PL (2005). «Vitamin C and Vitamin E for Alzheimer's Disease». The Annals of Pharmacotherapy. 39 (12): 2073–80. PMID 16227450. doi:10.1345/aph.1E495
- ↑ Isaac MG, Quinn R, Tabet N (2008). «Vitamin E for Alzheimer's Disease and Mild Cognitive Impairment». The Cochrane Database of Systematic Reviews (3): CD002854. PMID 18646084. doi:10.1002/14651858.CD002854.pub2
- ↑ Loef M, Schrauzer GN, Walach H (2011). «Selenium and Alzheimer's disease: a systematic review». Journal of Alzheimer's Disease. 26 (1): 81–104. PMID 21593562. doi:10.3233/JAD-2011-110414
- ↑ Loef M, von Stillfried N, Walach H (1 de setembro de 2012). «Zinc diet and Alzheimer's disease: a systematic review». Nutritional Neuroscience. 15 (5): 2–12. PMID 22583839. doi:10.1179/1476830512Y.0000000010
- ↑ Malouf R, Grimley Evans J (2008). «Folic Acid with or without Vitamin B12 for the Prevention and Treatment of Healthy Elderly and Demented people». The Cochrane Database of Systematic Reviews (4): CD004514. PMID 18843658. doi:10.1002/14651858.CD004514.pub2
- ↑ Wald DS, Kasturiratne A, Simmonds M (Junho de 2010). «Effect of Folic Acid, with or without other B vitamins, on Cognitive Decline: Meta-analysis of Randomized trials». The American Journal of Medicine. 123 (6): 522–527.e2. PMID 20569758. doi:10.1016/j.amjmed.2010.01.017
- ↑ Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P (Janeiro de 2013). «Docosahexaenoic acid homeostasis, brain aging and Alzheimer's disease: Can we reconcile the evidence?». Prostaglandins, Leukotrienes, and Essential Fatty Acids. 88 (1): 61–70. PMID 22575581. doi:10.1016/j.plefa.2012.04.006
- ↑ Hamaguchi T, Ono K, Yamada M (Outubro de 2010). «REVIEW: Curcumin and Alzheimer's disease». CNS Neuroscience & Therapeutics. 16 (5): 285–97. PMID 20406252. doi:10.1111/j.1755-5949.2010.00147.x
- ↑ Birks J, Grimley Evans J (2009). «Ginkgo Biloba for Cognitive Impairment and Dementia». The Cochrane Database of Systematic Reviews (1): CD003120. PMID 19160216. doi:10.1002/14651858.CD003120.pub3
- ↑ Krishnan S, Cairns R, Howard R (2009). Krishnan, Sarada, ed. «Cannabinoids for the treatment of dementia». The Cochrane Database of Systematic Reviews (2): CD007204. PMID 19370677. doi:10.1002/14651858.CD007204.pub2
- ↑ Bilkei-Gorzo A (2012). «The endocannabinoid system in normal and pathological brain ageing». Philos. Trans. R. Soc. Lond., B, Biol. Sci. 367 (1607): 3326–41. PMC 3481530
 . PMID 23108550. doi:10.1098/rstb.2011.0388
. PMID 23108550. doi:10.1098/rstb.2011.0388
- ↑ Fergusson E, Howard R. Donepezil for the treatment of psychosis in dementia with Lewy bodies. Int J Geriatr Psychiatry. 2000;15(3):280-1.
- ↑ ALMEIDA, OSVALDO P.. Tratamento da doença de Alzheimer: avaliação crítica sobre o uso de anticolinesterásicos. Arq. Neuro-Psiquiatr. [online]. 1998, vol.56, n.3B [cited 2011-03-04], pp. 688-696 . Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-282X1998000400029&lng=en&nrm=iso>. ISSN 0004-282X. doi: 10.1590/S0004-282X1998000400029.
- ↑ Farlow MR, Lahiri DK, Poirier J, Davignon J, Schneider L, Hui SL. Treatment outcome of tacrine therapy depends on apolipoprotein genotype and gender of the subjects with Alzheimer's disease. Neurology 1998;50:669-677.
- ↑ Forlenza OV. Transtornos depressivos na doença de Alzheimer: diagnóstico e tratamento. Rev Bras Psiquiatr. 2000;22(2):87-95.
- ↑ SERENIKI, Adriana and VITAL, Maria Aparecida Barbato Frazão. A doença de Alzheimer: aspectos fisiopatológicos e farmacológicos. Rev. psiquiatr. Rio Gd. Sul [online]. 2008, vol.30, n.1, suppl. [cited 2011-03-04], pp. 0-0 . Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0101-81082008000200002&lng=en&nrm=iso>. ISSN 0101-8108. doi: 10.1590/S0101-81082008000200002.
- ↑ Szekely CA, Thorne JE, Zandi PP, et al. Nonsteroidal anti-inflammatory drugs for the prevention of Alzheimer’s disease: a systematic review. Neuroepidemiology, 2004;23:159-169.
- ↑ Tuppo EE, Arias HR. The role of inflammation in Alzheimer's disease. Int J Biochem Cell Biol. 2005;37(2):289-305.
- ↑ «Reversal Of Alzheimer's Symptoms Within Minutes In Human Study». Consultado em 13 de janeiro de 2008
- ↑ Peter Hedlund and Elizabeth Thomas of Scripps Research, and Floyd Bloom and Brian Hilbush (2011) Peripheral reduction of β-amyloid is sufficient to reduce brain Aβ: implications for Alzheimer's disease. http://www.sciencedaily.com/releases/2011/03/110303134435.htm
- ↑ Alzheimer's: Deep brain stimulation 'reverses' disease
- ↑ «http://en.wikipedia.org/wiki/Gammagard». Consultado em 25 de julho de 2012 Ligação externa em
|titulo=(ajuda) - ↑ «http://www.guardian.co.uk/society/2012/jul/18/alzheimers-drug-ivig-halt-decline?INTCMP=SRCH». Consultado em 25 de julho de 2012 Ligação externa em
|titulo=(ajuda) - ↑ «http://www.telesurtv.net/articulos/2012/07/25/prueban-con-exito-farmaco-que-detiene-deterioro-del-alzheimer-en-ee.uu-1671.html». Consultado em 25 de julho de 2012 Ligação externa em
|titulo=(ajuda) - ↑ a b c d Rabins PV, Blacker D, Rovner BW, Rummans T, Schneider LS, Tariot PN, Blass DM, McIntyre JS, Charles SC, Anzia DJ, Cook IA, Finnerty MT, Johnson BR, Nininger JE, Schneidman B, Summergrad P, Woods SM, Berger J, Cross CD, Brandt HA, Margolis PM, Shemo JP, Blinder BJ, Duncan DL, Barnovitz MA, Carino AJ, Freyberg ZZ, Gray SH, Tonnu T, Kunkle R, Albert AB, Craig TJ, Regier DA, Fochtmann LJ (December 2007). «American Psychiatric Association practice guideline for the treatment of patients with Alzheimer's disease and other dementias». The American Journal of Psychiatry. 164 (12 Suppl): 5–56. PMID 18340692 Verifique data em:
|data=(ajuda) - ↑ Bottino CM, Carvalho IA, Alvarez AM, Avila R, Zukauskas PR, Bustamante SE, Andrade FC, Hototian SR, Saffi F, Câmargo CH (2005). «Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study». Clinical Rehabilitation. 19 (8): 861–869. PMID 16323385. doi:10.1191/0269215505cr911oa
- ↑ Doody RS, Stevens JC, Beck C, Dubinsky RM, Kaye JA, Gwyther L, Mohs RC, Thal LJ, Whitehouse PJ, DeKosky ST, Cummings JL (2001). «Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology». Neurology. 56 (9): 1154–1166. PMID 11342679. doi:10.1212/WNL.56.9.1154
- ↑ Hermans DG, Htay UH, McShane R (2007). Htay, U Hla, ed. «Non-pharmacological interventions for wandering of people with dementia in the domestic setting». The Cochrane Database of Systematic Reviews (1): CD005994. PMID 17253573. doi:10.1002/14651858.CD005994.pub2
- ↑ Robinson L, Hutchings D, Dickinson HO, Corner L, Beyer F, Finch T, Hughes J, Vanoli A, Ballard C, Bond J (2007). «Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review». International Journal of Geriatric Psychiatry. 22 (1): 9–22. PMID 17096455. doi:10.1002/gps.1643
- ↑ Woods B, Spector A, Jones C, Orrell M, Davies S (2005). Woods, Bob, ed. «Reminiscence therapy for dementia». The Cochrane Database of Systematic Reviews (2): CD001120. PMID 15846613. doi:10.1002/14651858.CD001120.pub2
- ↑ Zetteler J (Novembro de 2008). «Effectiveness of simulated presence therapy for individuals with dementia: a systematic review and meta-analysis». Aging & Mental Health. 12 (6): 779–85. PMID 19023729. doi:10.1080/13607860802380631
- ↑ Neal M, Briggs M (2003). Neal, Martin, ed. «Validation therapy for dementia». The Cochrane Database of Systematic Reviews (3): CD001394. PMID 12917907. doi:10.1002/14651858.CD001394
- ↑ {{cite journal | author = Chung JC, Lai CK, Chung PM, French HP | title = Snoezelen for dementia | journal = The Cochrane Database of Systematic Reviews | issue = 4 | pages = CD003152 | year = 2002 | pmid = 12519587 | doi = 10.1002/14651858.CD003152 | editor1-last = Chung | editor1-first = Jenny CC }
- ↑ Spector A, Orrell M, Davies S, Woods B (2000). Spector, Aimee E, ed. «Withdrawn: reality orientation for dementia». The Cochrane Database of Systematic Reviews (3): CD001119. PMID 17636652. doi:10.1002/14651858.CD001119.pub2
- ↑ Spector A, Thorgrimsen L, Woods B, Royan L, Davies S, Butterworth M, Orrell M (2003). «Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial». The British Journal of Psychiatry. 183 (3): 248–254. PMID 12948999. doi:10.1192/bjp.183.3.248
- ↑ Caldas CP. Cuidando do idoso que vivencia uma síndrome demencial: a família como cliente da enfermagem. Texto & Contexto Enferm 2001; 10 (2): 68-93..
- ↑ Poliana de França Albuquerque Paes, Fátima Helena do Espírito Santo.(2005) LIMITES E POSSIBILIDADES NO COTIDIANO DO FAMILIAR QUE CUIDA DO IDOSO COM ALZHEIMER NO AMBIENTE DOMICILIAR. http://www.eean.ufrj.br/REVISTA_ENF/2005_vol09/2005_vol09n02AGOSTO.pdf#page=32
- ↑ a b Bowen JD, Malter AD, Sheppard L, Kukull WA, McCormick WC, Teri L, Larson EB (1996). «Predictors of Mortality in Patients Diagnosed with Probable Alzheimer's Disease». Neurology. 47 (2): 433–9. PMID 8757016
- ↑ a b Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (2003). «Functional Transitions and Active Life Expectancy Associated with Alzheimer Disease». Archives of Neurology. 60 (2): 253–9. PMID 12580712. doi:10.1001/archneur.60.2.253
- ↑ a b Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (2005). «Alzheimer Disease and Mortality: A 15-year Epidemiological Study». Archives of Neurology. 62 (5): 779–84. PMID 15883266. doi:10.1001/archneur.62.5.779
- ↑ Larson EB, Shadlen MF, Wang L, McCormick WC, Bowen JD, Teri L, Kukull WA (2004). «Survival after Initial Diagnosis of Alzheimer Disease». Annals of Internal Medicine. 140 (7): 501–9. PMID 15068977
- ↑ Jagger C, Clarke M, Stone A (1995). «Predictors of Survival with Alzheimer's Disease: A Community-based Study». Psychological Medicine. 25 (1): 171–7. PMID 7792352. doi:10.1017/S0033291700028191
- ↑ a b Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (2008). «Incidence and subtypes of dementia in three elderly populations of central Spain». Journal of the Neurological Sciences. 264 (1–2): 63–72. PMID 17727890. doi:10.1016/j.jns.2007.07.021
- ↑ a b c Di Carlo A, Baldereschi M, Amaducci L, Lepore V, Bracco L, Maggi S, Bonaiuto S, Perissinotto E, Scarlato G, Farchi G, Inzitari D (2002). «Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study». Journal of the American Geriatrics Society. 50 (1): 41–8. PMID 12028245. doi:10.1046/j.1532-5415.2002.50006.x
- ↑ Andersen K, Launer LJ, Dewey ME, Letenneur L, Ott A, Copeland JR, Dartigues JF, Kragh-Sorensen P, Baldereschi M, Brayne C, Lobo A, Martinez-Lage JM, Stijnen T, Hofman A (1999). «Gender Differences in the Incidence of AD and Vascular Dementia: The EURODEM Studies. EURODEM Incidence Research Group». Neurology. 53 (9): 1992–7. PMID 10599770
- ↑ McGeer PL, Schulzer M, McGeer EG. (1996). «Arthritis and anti-inflammatory agents as possible protective factors for Alzheimer's disease: a review of 17 epidemiologic studies.». Neurology (47): 425-432
- ↑ Raquel Lemos; Cristina Martins; Mário R. Simões; Isabel Santana (2012). «Estudo de adaptação do Teste de Recordação Selectiva Livre e Guiada para a população portuguesa». Aval. psicol. 11 (1)
- ↑ Ivan Aprahamian, José Eduardo Martinelli, Mônica Sanches Yassuda (2009). «Doença de Alzheimer: revisão da epidemiologia e diagnóstico.». Rev Bras Clin Med (7): 27-35
- ↑ Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (2003). «Alzheimer Disease in the US population: Prevalence Estimates Using the 2000 census». Archives of Neurology. 60 (8): 1119–22. PMID 12925369. doi:10.1001/archneur.60.8.1119
- ↑ «Profiles of General Demographic Characteristics, 2000 Census of Population and Housing, United States» (PDF). U.S. Census Bureau. 2001. Cópia arquivada (PDF) em 19 de agosto de 2008
- ↑ a b Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, Hall K, Hasegawa K, Hendrie H, Huang Y, Jorm A, Mathers C, Menezes PR, Rimmer E, Scazufca M (2005). «Global Prevalence of Dementia: A Delphi Consensus Study». Lancet. 366 (9503): 2112–7. PMC 2850264
 . PMID 16360788. doi:10.1016/S0140-6736(05)67889-0
. PMID 16360788. doi:10.1016/S0140-6736(05)67889-0
- ↑ World Health Organization (2006). Neurological Disorders: Public Health Challenges. Switzerland: World Health Organization. pp. 204–207. ISBN 978-92-4-156336-9
- ↑ «World population prospects: the 2006 revision, highlights» (PDF). Population Division, Department of Economic and Social Affairs, United Nations. Working Paper No. ESA/P/WP.202. 2007. Consultado em 27 August 2008 Verifique data em:
|acessodata=(ajuda) - ↑ Alzheimer Alois (1907). «Über eine eigenartige Erkrankung der Hirnrinde» [About a peculiar disease of the cerebral cortex]. Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin. 64 (1–2): 146–148
- ↑ Alzheimer Alois; L. Jarvik and H. Greenson (1987). «About a Peculiar Disease of the Cerebral Cortex». Alzheimer Disease and Associated Disorders. 1 (1): 3–8. PMID 3331112
- ↑ Maurer Ulrike, Maurer Konrad (2003). Alzheimer: The Life of a Physician and the Career of a Disease. New York: Columbia University Press. p. 270. ISBN 0-231-11896-1
- ↑ Berrios G E (1990). «Alzheimer's Disease: A Conceptual History». Int. J. Ger. Psychiatry. 5 (6): 355–365. doi:10.1002/gps.930050603
- ↑ Kraepelin Emil, Diefendorf A. Ross (translated by) (2007). Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). [S.l.]: Kessinger Publishing. p. 568. ISBN 1-4325-0833-4
- ↑ Katzman Robert, Terry Robert D, Bick Katherine L (editors) (1978). Alzheimer's Disease: Senile Dementia and Related Disorders. New York: Raven Press. p. 595. ISBN 0-89004-225-X
- ↑ Boller F, Forbes MM (1998). «History of Dementia and Dementia in History: An Overview». Journal of the Neurological Sciences. 158 (2): 125–33. PMID 9702682. doi:10.1016/S0022-510X(98)00128-2
- ↑ Amaducci LA, Rocca WA, Schoenberg BS. Origin of the Distinction between Alzheimer's Disease and Senile Dementia: How History Can Clarify Nosology. Neurology. 1986;36(11):1497–9. PMID 3531918.
- ↑ Allegri RF. Economic impact of dementia in developing countries: an evaluation of costs of Alzheimer-type dementia in Argentina. Int Psychogeriatr. 2007;19(4):705–18. doi:10.1017/S1041610206003784. PMID 16870037.
- ↑ Suh GH, Knapp M, Kang CJ. The economic costs of dementia in Korea, 2002. Int J Geriatr Psychiatry. 2006;21(8):722–8. doi:10.1002/gps.1552. PMID 16858741.
- ↑ Wimo A, Jonsson L, Winblad B. An estimate of the worldwide prevalence and direct costs of dementia in 2003. Dement Geriatr Cogn Disord. 2006;21(3):175–81. doi:10.1159/000090733. PMID 16401889.
Ligações externas
- «Alzheimer Portugal»
- «ABRAz - Associação Brasileira de Alzheimer»
- «IBNeuro - Inst. Bras. Neuropsicologia e Ciências Cognitivas»
- «Centro de Medicina do Idosos HUB/UnB»
- «Bases atuais da terapêutica»
- «Doença de Alzheimer: cuidados a ter com o doente»
- PolygenicPathways Um banco de dados de genes e fatores de risco envolvidos na doença de Alzheimer
- «Vídeo aula sobre Doença de Alzheimer»
Predefinição:Bom interwiki Predefinição:Bom interwiki Predefinição:Link FA Predefinição:Link FA Predefinição:Bom interwiki

